题目内容
10.过量的铁粉与100mL 0.1mol/L的稀盐酸反应,反应速率太快.为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的NaNO3固体 ⑤加NaCl溶液⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 1mol/L的盐酸.| A. | ①⑥⑦ | B. | ①⑤ | C. | ③⑧ | D. | ③⑥⑧ |
分析 为了降低此反应速率而不改变H2的产量,少量铁粉完全反应,则可降低氢离子浓度、降低温度等来降低反应速率,以此来解答.
解答 解:①加H2O,氢离子浓度减小,反应速率减慢,故正确;
②加NaOH固体,氢离子浓度减小,反应速率减慢,生成氢气的总量减小,故错误;
③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,故错误;
④加少量的NaNO3固体,由于硝酸具有强氧化性,则不生成氢气,故错误;
⑤加NaCl溶液,氢离子浓度减小,反应速率减慢,故正确;
⑥滴入几滴硫酸铜溶液,构成原电池,反应速率加快,故错误;
⑦升高温度(不考虑盐酸挥发),反应速率加快,故错误;
⑧改用10mL 1mol/L盐酸,氢离子浓度增大,反应速率加快,故错误;
故选B.
点评 本题考查影响反应速率的因素,为高频考点,侧重考查学生的分析能力,明确常见的温度、浓度、原电池对反应速率的影响即可解答,注意铁粉过量,生成的氢气由盐酸决定为解答的易错点,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
20.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 足量的Zn与一定量的浓H2SO4反应,标况下产生22.4L气体,转移电子数一定为2NA | |
| B. | lmolC12参加反应转移的电子数一定为2NA | |
| C. | 将含0.lmolFeCl3的饱和溶液滴入一定量的沸水中得到Fe(OH)3胶体,其胶体微粒为0.lNA | |
| D. | 50mL,l2 mo1•L-1的盐酸与足量MnO2共热,转移电子数为0.3NA |
1.一定温度下,m g下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠完全反应,过氧化钠增质量加了n g,且n>m,符合此要求的物质是①H2②CO ③CO和H2的混合物 ④HCOOH ⑤CH3CHO( )
| A. | ①②③ | B. | ⑤ | C. | ④ | D. | ①②③④ |
18.下述实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 将CO2(含HC1杂质)通入饱和NaHCO3溶液中 | 除去HC1 |
| B | 向做完银镜反应后的试管中加入稀氨水 | 除去试管内残留物 |
| C | 向食盐溶液中滴加少量淀粉溶液 | 鉴别真假碘盐 |
| D | 将少量FeC12试样加水溶解,加稀硝酸酸化,再滴加KSCN溶液 | 检验FeCl2试样是否变质 |
| A. | A | B. | B | C. | C | D. | D |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 78 g苯含有的C=C键数目为3NA | |
| B. | lmol C10H20分子中共用电子对总数为31 NA | |
| C. | 1 L 1 mol•L-1苯酚钠溶液中含有  的个数为NA 的个数为NA | |
| D. | 1mol甲烷与足量氧气发生反应,转移电子数为8 NA |
2.下面关于 SiO2晶体网状结构的叙述正确的是( )
| A. | 存在四面体结构单元,O 处于中心,Si 处于 4 个顶角 | |
| B. | 最小的环上,有 3 个 Si 原子和 3 个 O 原子 | |
| C. | 最小的环上,Si 和 O 原子数之比为 1:2 | |
| D. | 最小的环上,有 6 个 Si 原子和 6 个 O 原子 |
19.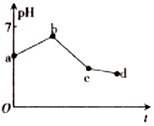 用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )
用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )
 用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )
用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )| A. | ab段H+被还原,溶液的pH 增大 | |
| B. | cd 段相当于电解水 | |
| C. | c点时加人适量CuCl2固体,电解液可恢复原来浓度 | |
| D. | 原溶液中KCl和CuSO4的物质的量浓度之比为2:1 |
20.下列有关于氯及其化合物的说法不正确的是( )
| A. | 电解饱和食盐水可制得黄绿色的氯气 | |
| B. | 氢气在氯气中安静地燃烧,发出黄色火焰,生成物溶于水可制得盐酸 | |
| C. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| D. | Cl2能与铁反应生成氯化铁 |
