题目内容
 已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:
已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:【提出假设】
(1)对固体产物中Fe化合价的猜想
猜想一:只显+2价;猜想二:只显+3价;猜想三:
【实验验证】
(2)同学们设计并验证试验,取适量上述加热分解后的固体于试管中,加入足量的0.1mol/L H2SO4溶液,使固体完全溶解,再进行下列实验操作,实验结果证明溶液中只含有Fe3+,不含有Fe2+.
(提示:由于浓度较稀,不能以Fe3+和Fe2+例子本身的颜色进行确认)
A、先向试管中滴入KSCN溶液,溶液呈红色,再向试管中滴加3%的H2O2溶液,溶液呈红色.
B、先向试管中滴入3%的H2O2溶液,无明显变化,再向试管中滴入KSCN溶液,溶液呈红色.
C、先向试管中滴入0.01mol/L的高锰酸钾溶液,溶液呈紫色,再向试管中滴入KSCN溶液,溶液呈红色.
D、先向试管中滴入KSCN溶液,溶液呈红色,再向试管中滴加K3[Fe(CN)6]溶液,溶液无明显变化.
【实验结论】
(3)根据上述实验结果,证明猜想二正确,请写出Fe(NO3)2热分解的化学方程式
【实验改进】
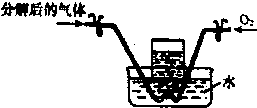
(4)有同学提出也可以通过测定分解后的气体体积的方式进行分析,于是将分解后的气体进行右图装置的试验,以验证猜想:先向集气瓶中通入分解后的气体,记录通入气体的体积为V1,然后,打开右侧止水夹,再向吸气瓶中缓慢通入O2,观察到的现象是:
考点:性质实验方案的设计,二价Fe离子和三价Fe离子的检验
专题:实验探究和数据处理题
分析:(1)根据Fe元素有+2价、+3价来分析;
(2)根据铁离子、亚铁离子的检验方法进行判断;
(3)猜想二正确,说明硝酸亚铁分解生成产物只有氧化铁,根据氧化还原反应中化合价升降相等配平反应的化学方程式;
(4)一氧化氮与氧气反应生成红棕色的二氧化氮气体;如果猜想二成立,反应生成二氧化氮与氧气的体积比为8:1,混合气体中二氧化氮为
V1,氧气为
V1,根据反应4NO2+O2+2H2O=4HNO3,x=4(y+V2)判断混合气体完全被吸收还需要的氧气的体积.
(2)根据铁离子、亚铁离子的检验方法进行判断;
(3)猜想二正确,说明硝酸亚铁分解生成产物只有氧化铁,根据氧化还原反应中化合价升降相等配平反应的化学方程式;
(4)一氧化氮与氧气反应生成红棕色的二氧化氮气体;如果猜想二成立,反应生成二氧化氮与氧气的体积比为8:1,混合气体中二氧化氮为
| 8 |
| 9 |
| 1 |
| 9 |
解答:
解:(1)Fe元素有+2价、+3价,所以产物可能为:猜想一:只显+2价;猜想二:只显+3价;猜想三:既有+2价又有+3价,
故答案为:既有+2价又有+3价;
(2)A、先向试管中滴入KSCN溶液,溶液呈红色,溶液中含有铁离子,再向试管中滴加3%的H2O2溶液,溶液呈红色,法判断原溶液中是否存在无亚铁离子,故A错误;
B、先向试管中滴入3%的H2O2溶液,无明显变化,再向试管中滴入KSCN溶液,溶液呈红色,由于先加入了氧化剂双氧水,无法判断原溶液中存在亚铁离子还是铁离子,故B错误;
C、先向试管中滴入0.01mol/L的高锰酸钾溶液,溶液呈紫色,证明溶液中不存在亚铁离子,再向试管中滴入KSCN溶液,溶液呈红色,证明原溶液中一定存在铁离子,故C正确;
D、先向试管中滴入KSCN溶液,溶液呈红色,证明溶液中存在铁离子,再向试管中滴加K3[Fe(CN)6]溶液,溶液无明显变化,证明溶液中一定不存在亚铁离子,故D正确;
故答案为:CD;
(3)根据上述实验结果,证明猜想二正确,硝酸亚铁分解生成氧化铁、二氧化氮和氧气,Fe(NO3)2热分解的化学方程式为:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑,
故答案为:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑;
(4)根据化合价变化可知,如果反应生成氧化亚铁,二氧化氮与氧气的体积比为4:1,如果生成氧化铁,则生成的二氧化氮与氧气的体积比大于4:1,将反应后的气体通入水中,如果有气体剩余,则反应后的气体为NO,所以向集气瓶中通入氧气后,无色气体会变成红色,溶液的液面会上升;
再通入氧气体积为V1时,集气瓶中充满溶液,根据反应4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑可知,如果猜想二成立,混合气体中二氧化氮体积为
V1,氧气为
V1,再根据反应4NO2+O2+2H2O=4HNO3,如果二氧化氮完全反应,需要消耗
×
V1=
V1,还需要通入氧气的体积为:
V1,
故答案为:瓶内颜色由无色变为红棕色,液面上升;
V1.
故答案为:既有+2价又有+3价;
(2)A、先向试管中滴入KSCN溶液,溶液呈红色,溶液中含有铁离子,再向试管中滴加3%的H2O2溶液,溶液呈红色,法判断原溶液中是否存在无亚铁离子,故A错误;
B、先向试管中滴入3%的H2O2溶液,无明显变化,再向试管中滴入KSCN溶液,溶液呈红色,由于先加入了氧化剂双氧水,无法判断原溶液中存在亚铁离子还是铁离子,故B错误;
C、先向试管中滴入0.01mol/L的高锰酸钾溶液,溶液呈紫色,证明溶液中不存在亚铁离子,再向试管中滴入KSCN溶液,溶液呈红色,证明原溶液中一定存在铁离子,故C正确;
D、先向试管中滴入KSCN溶液,溶液呈红色,证明溶液中存在铁离子,再向试管中滴加K3[Fe(CN)6]溶液,溶液无明显变化,证明溶液中一定不存在亚铁离子,故D正确;
故答案为:CD;
(3)根据上述实验结果,证明猜想二正确,硝酸亚铁分解生成氧化铁、二氧化氮和氧气,Fe(NO3)2热分解的化学方程式为:4Fe(NO3)2
| ||
故答案为:4Fe(NO3)2
| ||
(4)根据化合价变化可知,如果反应生成氧化亚铁,二氧化氮与氧气的体积比为4:1,如果生成氧化铁,则生成的二氧化氮与氧气的体积比大于4:1,将反应后的气体通入水中,如果有气体剩余,则反应后的气体为NO,所以向集气瓶中通入氧气后,无色气体会变成红色,溶液的液面会上升;
再通入氧气体积为V1时,集气瓶中充满溶液,根据反应4Fe(NO3)2
| ||
| 8 |
| 9 |
| 1 |
| 9 |
| 1 |
| 4 |
| 8 |
| 9 |
| 2 |
| 9 |
| 1 |
| 9 |
故答案为:瓶内颜色由无色变为红棕色,液面上升;
| 1 |
| 9 |
点评:本题考查了性质实验方案的设计、铁离子和亚铁离子的检验方法,题目难度中等,注意掌握铁离子与亚铁离子的性质及正确的检验方法,明确性质实验方案的设计原则.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的是( )
| A、CuFeS2仅作还原剂,硫元素被氧化 |
| B、每生成1mol Cu2S,有4 mol硫被氧化 |
| C、SO2只是氧化产物,FeS只是还原产物 |
| D、每转移1.2 mol电子,有0.2 mol硫被氧化 |
短周期元素W、X、Y、Z的原子序数依次增大.W元素的最外层电子数是内层电子数的3倍;1mol X单质能与冷水反应,在标准状况下生成11.2L H2;Y原子最外层电子数等于其周期序数;Z负二价阴离子的电子层结构与Ar原子相同.下列说法不正确的是( )
| A、上述四种元素的原子半径大小为X>Y>Z>W |
| B、化合物X2W2中存在两种类型的化学键 |
| C、依据最高价氧化物对应水化物的碱性强弱可以比较X和Y的金属性强弱 |
| D、W、Z的氢化物的沸点:HmW<HmZ |
