题目内容
5.6g铁粉投入到盛有100mL 2mol/L稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
| A、v(Fe)=0.05 mol/(L?min) |
| B、v(H2SO4)=0.1 mol/(L?min) |
| C、v(H2SO4)=0.5 mol/(L?min) |
| D、v(FeSO4)=0.1 mol/(L?min) |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:铁粉的物质的量为:
=0.1mol,则参加反应的硫酸的物质的量也是0.1mol,故参加反应的硫酸的物质的量浓度为:
=1mol/L;根据v=
和化学反应速率之比等化学计量数之比进行计算.
| 5.6 |
| 56 |
| 0.1 |
| 0.1 |
| △c |
| t |
解答:
解:铁粉的物质的量为:
=0.1mol,则参加反应的硫酸的物质的量也是0.1mol,故参加反应的硫酸的物质的量浓度为:
=1mol/L;
则v(H2SO4)=
=
=0.5 mol/(L?min);
A.铁是固体,不能用于表示反应速率,故A错误;
B.v(H2SO4)=0.5 mol/(L?min),故B错误;
C.v(H2SO4)=0.5 mol/(L?min),故C正确;
D.v(FeSO4)=v(H2SO4)=0.5 mol/(L?min),故D错误;
故选C.
| 5.6 |
| 56 |
| 0.1 |
| 0.1 |
则v(H2SO4)=
| △c |
| t |
| 2mol/L-1mol/L |
| 2min |
A.铁是固体,不能用于表示反应速率,故A错误;
B.v(H2SO4)=0.5 mol/(L?min),故B错误;
C.v(H2SO4)=0.5 mol/(L?min),故C正确;
D.v(FeSO4)=v(H2SO4)=0.5 mol/(L?min),故D错误;
故选C.
点评:本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,难度不大.要注意固体不能用于表示反应速率.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0.下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
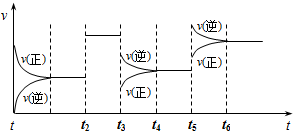

| A、t2时加入了催化剂 |
| B、t3时降低了温度 |
| C、t5时增大了压强 |
| D、该反应最初是从逆反应开始的 |
下列反应中,反应前后元素的化合价没有变化的是( )
A、CO2+C
| ||||
| B、SO2+H2O=H2SO3 | ||||
| C、2NaOH+Cl2═NaCl+NaClO+H2O | ||||
D、2CO+O2
|
下列离子方程式书写正确的是( )
| A、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
| C、碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
密闭容器内发生氨分解反应:2NH3?N2+3H2.已知NH3起始浓度是2.6mol?L-1,4s末为1.0mol?L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为( )
| A、0.04 mol?L-1?s-1 |
| B、0.4 mol?L-1?s-1 |
| C、1.6 mol?L-1?s-1 |
| D、0.8 mol?L-1?s-1 |
下列说法正确的是( )
| A、硅酸胶体通常带正电 |
| B、直径为1nm---100nm的微粒是胶体 |
| C、在标准状况下,1mol苯的体积约是22.4L |
| D、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |
下列说法正确是( )
| A、摩尔是物质的质量单位 |
| B、氧气的摩尔质量是32g |
| C、0.5mol氮气的体积为11.2L |
| D、1mol硫酸根的质量为96g |
某溶液中只含有大量的下列离子:Fe3+、NO3-、K+和M离子,经测定Fe3+、NO3-、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是下列中的( )
| A、Cl- |
| B、SO42- |
| C、Ca2+ |
| D、Na+ |