题目内容
1. 化合物I的分子式为C6H10O4,75%的A溶液常用于医疗消毒,与I相关的反应如图.根据以上信息回答下列问题.
化合物I的分子式为C6H10O4,75%的A溶液常用于医疗消毒,与I相关的反应如图.根据以上信息回答下列问题.(1)写出A中所含官能团的名称羟基,B的结构简式CH2=CH2.
(2)写出D→E的化学方程式CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O.
(3)写出一个F的同分异构体的结构简式(不要求环状)CH3OOCH或HO-CH2-CHO.
(4)工业上用B与O2在催化剂条件下产生环氧乙烷,写出该反应的化学方程式2CH2=CH2+O2 $\stackrel{催化剂}{→}$2
 .
.(5)若1molG可以和2molNaHCO3反应,则I可能的结构简式为CH3CH2OOC-COOCH2CH3等.
分析 75%的A溶液常用于医疗消毒,则A为CH3CH2OH,乙醇发生催化氧化得到D为CH3CHO,乙醛与新制氢氧化铜发生氧化反应得到E,E酸化得到F,则E为CH3COONa,F为CH3COOH.乙醇发生消去反应生成B为CH2=CH2,乙烯发生加聚反应得到C为 .化合物I的分子式为C6H10O4,酸性水解得到乙醇与G,则I含有酯基,G中含有羧基,(5)中若1molG可以和2molNaHCO3反应,则G中含有2个-COOH,故G为可能为HOOC-COOH,I结构简式可能为CH3CH2OOC-COOCH2CH3,据此解答.
.化合物I的分子式为C6H10O4,酸性水解得到乙醇与G,则I含有酯基,G中含有羧基,(5)中若1molG可以和2molNaHCO3反应,则G中含有2个-COOH,故G为可能为HOOC-COOH,I结构简式可能为CH3CH2OOC-COOCH2CH3,据此解答.
解答 解:75%的A溶液常用于医疗消毒,则A为CH3CH2OH,乙醇发生催化氧化得到D为CH3CHO,乙醛与新制氢氧化铜发生氧化反应得到E,E酸化得到F,则E为CH3COONa,F为CH3COOH.乙醇发生消去反应生成B为CH2=CH2,乙烯发生加聚反应得到C为 .化合物I的分子式为C6H10O4,酸性水解得到乙醇与G,则I含有酯基,G中含有羧基.
.化合物I的分子式为C6H10O4,酸性水解得到乙醇与G,则I含有酯基,G中含有羧基.
(1)A为CH3CH2OH,含有的官能团为羟基,B的结构简式为:CH2=CH2,
故答案为:羟基;CH2=CH2;
(2)D→E的化学方程式:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O,
故答案为:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O;
(3)一个F(CH3COOH)的同分异构体的结构简式(不要求环状):CH3OOCH或HO-CH2-CHO,
故答案为:CH3OOCH或HO-CH2-CHO;
(4)工业上用乙烯与O2在催化剂条件下产生环氧乙烷,该反应的化学方程式:2CH2=CH2+O2 $\stackrel{催化剂}{→}$2 ,
,
故答案为:2CH2=CH2+O2 $\stackrel{催化剂}{→}$2 ;
;
(5)中若1molG可以和2molNaHCO3反应,则G中含有2个-COOH,故G为可能为HOOC-COOH等,I结构简式可能为CH3CH2OOC-COOCH2CH3等,
故答案为:CH3CH2OOC-COOCH2CH3等.
点评 本题考查有机物推断,关键是确定A为乙醇,再结合反应条件进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

 53天天练系列答案
53天天练系列答案Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
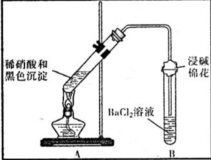 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
| A. | 它与乙烯可能是同系物 | |
| B. | 一氯代物只有一种 | |
| C. | 分子结构中甲基的数目可能是0、1、2 | |
| D. | 等质量的CH4和C4H8,分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
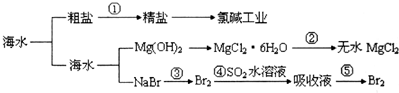
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取的 | |
| C. | ④和⑤步的目的是为了浓缩 | |
| D. | 第③④⑤步中溴元素均被氧化 |
| A. | 过量SO2通入NaOH溶液中发生SO2+2OH-═SO32-反应 | |
| B. | BF3分子中所有原子都满足最外层8电子结构 | |
| C. | 某元素原子的最外层只有2个电子,则该元素一定是ⅡA族元素 | |
| D. | 使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在 |
aTiO2+bCl2+cC$\frac{\underline{\;1173K\;}}{\;}$aTiCl4+cCO …反应Ⅰ
TiCl4+2Mg$\frac{\underline{\;1220K~1420K\;}}{\;}$Ti+2MgCl2…反应Ⅱ
下列分析不正确的是( )
| A. | TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂 | |
| B. | C、Mg在反应中均为还原剂,被氧化 | |
| C. | 每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移1.6 mol e- | |
| D. | 反应I中b=c=2,反应II中Mg的还原性大于Ti |
| A. | K+、Ba2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | Fe2+、NO3-、I-、Cl- |
 请按要求回答下列问题:
请按要求回答下列问题: .
.