题目内容
14.化学是材料科学发展的基础.下列说法正确的是( )| A. | 可用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| B. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| C. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
分析 A.胶体是分散质粒子介于1-100nm之间的分散系,属于混合物;
B.根据高分子化合物的定义判断;
C.陶瓷、玻璃、水泥主要成分都是硅酸盐;
D.有机玻璃的主要成分是有机物.
解答 解:A.胶体是分散质粒子介于1-100nm之间的分散系,属于混合物,而荧光灯内壁保护层的纳米氧化铝是纯净物,故不是胶体,故A错误;
B.高分子化合物的相对分子质量在10000以上,而油脂的相对分子质量较小,不是高分子化合物,故B错误;
C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品,故C正确;
D.有机玻璃的主要成分是有机物,不是硅酸盐,故D错误;
故选:C.
点评 本题考查了化学知识在生产和生活中的运用,熟悉胶体、高分子化合物的概念,常见的硅酸盐产品是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.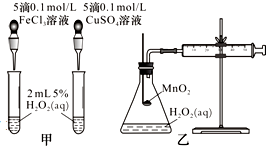 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略).
①实验1、2研究的是温度对H2O2分解速率的影响.
②实验2、3的目的是比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异.
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是控制阴离子相同,排除阴离子的干扰.
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是收集40mL气体所需时间.
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快.对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是放热反应,导致溶液温度升高,反应速率加快;
②从影响化学反应速率的因素看,你认为还可能是催化剂(Mn2+的催化作用)的影响.要证明你的猜想,实验方案是用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢.
 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
①实验1、2研究的是温度对H2O2分解速率的影响.
②实验2、3的目的是比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异.
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是控制阴离子相同,排除阴离子的干扰.
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是收集40mL气体所需时间.
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快.对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是放热反应,导致溶液温度升高,反应速率加快;
②从影响化学反应速率的因素看,你认为还可能是催化剂(Mn2+的催化作用)的影响.要证明你的猜想,实验方案是用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢.
2.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| B. | 金属钠、电石着火时,直接用高压水枪喷水扑灭 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 家庭中洁厕灵与“84消毒液”不能同时使用 |
9.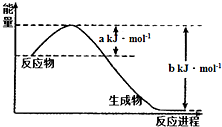 碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
(1)图是1mol NO2气体和1molCO反应生成CO2和NO过程中能量变化示意图.写出此反应的热化学方程式为NO2(g)+CO(g) CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;
CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;
(2)在不同温度下,向VL密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)?N2(g)+CO2(g),达到平衡时的数据如下:
请回答下列问题:
①T1℃时,该反应的平衡常数K=$\frac{9}{16}$,若开始时反应物的用量均减小一半,平衡后NO的转化率将不变(“增大”、“减小”或“不变”)
②当该反应达到平衡后下列说法正确的是BCD(填序号).
A.2v(CO2)消耗=v(NO)生成
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO2的物质的量浓度均不再变化
③若T1<T2,则△H小于0(填“大于”或“小于”),
④T1℃时,若改变反应条件,导致NO浓度增大,则改变的条件可能是ADE(填序号).
A.增加NO的量 B.加入催化剂 C.减小CO2的量 D.缩小容器体积 E.升温
(3)若用CO和氧气构成燃料电池,以熔融Li2CO3-K2CO3作电解质,负极电极反应式是CO-2e-+CO32-=2CO2.
 碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.(1)图是1mol NO2气体和1molCO反应生成CO2和NO过程中能量变化示意图.写出此反应的热化学方程式为NO2(g)+CO(g)
 CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;
CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;(2)在不同温度下,向VL密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)?N2(g)+CO2(g),达到平衡时的数据如下:
| 温度/℃ | n (C)/mol | n(CO2)/mol |
| T1 | 0.3 | |
| T2 | 0.75 |
①T1℃时,该反应的平衡常数K=$\frac{9}{16}$,若开始时反应物的用量均减小一半,平衡后NO的转化率将不变(“增大”、“减小”或“不变”)
②当该反应达到平衡后下列说法正确的是BCD(填序号).
A.2v(CO2)消耗=v(NO)生成
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO2的物质的量浓度均不再变化
③若T1<T2,则△H小于0(填“大于”或“小于”),
④T1℃时,若改变反应条件,导致NO浓度增大,则改变的条件可能是ADE(填序号).
A.增加NO的量 B.加入催化剂 C.减小CO2的量 D.缩小容器体积 E.升温
(3)若用CO和氧气构成燃料电池,以熔融Li2CO3-K2CO3作电解质,负极电极反应式是CO-2e-+CO32-=2CO2.
19.下列有关叙述正确的是( )
| A. | 不需要加热就能发生的反应一定是放热反应 | |
| B. | 弱电解质溶液的导电能力一定比强电解质溶液的弱 | |
| C. | SO2溶于水,其水溶液能导电,故SO2是电解质 | |
| D. | 蔗糖、碳酸钙和水分别属于非电解质、强电解质和弱电解质 |
6.短周期元素 W、X、Y 和Z的原子序数依次增大.W原子是半径最小的原子,非金属元素 X 形成的一种单质能导电,元素 Y 是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的 2 倍.下列说法错误的是( )
| A. | 元素 Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素 X与 W形成的共价化合物有很多种 | |
| C. | 元素 W、X的氯化物中,各原子均满足 8 电子的稳定结构 | |
| D. | 元素 Z 可与元素 X 形成共价化合物 XZ2 |
 (提示:
(提示: 可表示为
可表示为 )
)

 ,G中的化学键有离子键、共价键,D跟G反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
,G中的化学键有离子键、共价键,D跟G反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.