题目内容
8.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A,D元素同主族,B,C元素同周期;A,B,C,D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如表所示:| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)乙物质的化学式为H2O2,丁物质中阴离子与阳离子的个数之比为1:2;
(2)自然界生成甲物质的反应的化学方程式为O2+N2$\frac{\underline{\;放电\;}}{\;}$2NO.
(3)丙与水反应制取某种气体时,发生反应的化学方程式为NaH+H2O=NaOH+H2↑.
(4)丁于水反应制取某种气体时,发生反应的化学方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
分析 A、B、C、D是四种短周期元素,它们的原子序数依次增大,甲物质为气体,遇空气变为红褐色,则甲为NO,则B为N、C为O元素;乙物质为液体,由A、C(O)元素组成,且原子个数比为1:1,则乙为H2O2,则A为H元素;D的化合价为+1价,C、D组成的丁为固体,A、D元素同主族,则D为Na元素,丙和丁中原子个数之比为1:1,则丙为NaH,丁为Na2O2,据此进行解答.
解答 解:A、B、C、D是四种短周期元素,它们的原子序数依次增大,甲物质为气体,遇空气变为红褐色,则甲为NO,则B为N、C为O元素;乙物质为液体,由A、C(O)元素组成,且原子个数比为1:1,则乙为H2O2,则A为H元素;D的化合价为+1价,C、D组成的丁为固体,A、D元素同主族,则D为Na元素,丙和丁中原子个数之比为1:1,丙为NaH,丁为为Na2O2,
(1)根据分析可知,乙为双氧水,化学式为H2O2;丁为Na2O2,过氧化钠中阳离子为钠离子,阴离子为过氧根离子,则过氧化钠中阴离子与阳离子的个数之比为1:2,
故答案为:H2O2;1:2;
(2)甲为NO,自然界中氮气与氧气在放电条件下得到NO,反应的化学方程式为:O2+N2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:O2+N2$\frac{\underline{\;放电\;}}{\;}$2NO;
(3)氢化钠(NaH)与水反应生成氢氧化钠和氢气,反应的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑;
(4)丁为过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题考查了无机推断,题目难度中等,正确推断各物质组成为解答关键,“物质为气体,遇空气变为红褐色”为突破口,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析、理解能力及逻辑推理能力.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 2-乙基丁烷 | B. | 2-乙基-1-丁烯 | ||
| C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  间氯甲苯 间氯甲苯 |
| A. | 乙烯分子的双键中有一键较易断裂 | |
| B. | 烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为120° | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 乙烯和环丙烷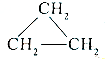 的分子组成符合通式CnH2n,因此它们属于同系物 的分子组成符合通式CnH2n,因此它们属于同系物 |

下列判断正确的是( )
| A. | 反应中氯气只起氧化剂的作用 | |
| B. | 溶液Ⅰ的溶质是KClO | |
| C. | 生成反应液II中的反应氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 溶液Ⅱ的溶液成分中含有K2FeO4 |
| A. | 用KOH溶液代替NaOH溶液 | B. | 用NaOH固体代替NaOH溶液 | ||
| C. | 反应物盐酸过量 | D. | 使用铜制搅拌棒搅拌 |
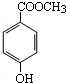 .
. ,其中包含的反应类型有取代反应或水解反应、中和反应.
,其中包含的反应类型有取代反应或水解反应、中和反应.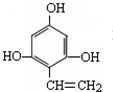 、
、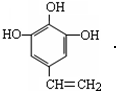 .
.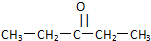
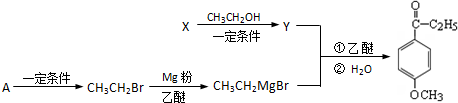
 .
. 一个CH3COOK微粒的质量约为
一个CH3COOK微粒的质量约为 g
g 3COOK的物质的量为1 mol
3COOK的物质的量为1 mol