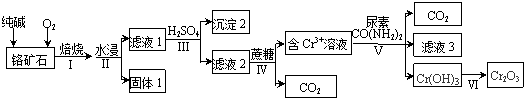
题目内容
13.下列用于解释事实的离子方程式书写正确的是( )| A. | 铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
分析 A.铁与氯化铁反应生成氯化亚铁;
B.硫离子的水解分步进行,离子方程式需要分步书写;
C.次氯酸为弱酸,离子方程式中不能拆开;
D.电解饱和食盐水生成氢氧化钠、氯气和氢气.
解答 解:A.铁粉溶于氯化铁溶液生成氯化亚铁,反应的离子方程式为:Fe+2Fe3+=3Fe2+,故A正确;
B.硫化钠溶液呈碱性,硫离子的水解主要以第一步为主,正确的离子方程式为:S2-+H2O?HS-+2OH-,故B错误;
C.氯水中含有次氯酸,则氯水具有漂白性,次氯酸小于保留化学式,正确的离子方程式为:Cl2+H2O?H++Cl-+HClO,故C错误;
D.工业上利用电解饱和食盐水制氯气,正确的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
3.对于100mL 0.5mol/LH2SO4溶液与铁片的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 1.0mol/LH2SO4溶液;③改用300mL 0.5mol/LH2SO4溶液;④用等量铁粉代替铁片;⑤改用质量分数为98%的H2SO4溶液( )
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
4.下列关于能量转化的认识不正确的是( )
| A. | 原电池工作时,化学能转化为电能 | |
| B. | 手机电池在充电时,是电能转变为化学能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 人体运动所消耗的能量与化学反应无关 |
1.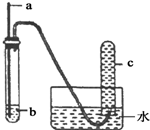 用下图所示装置进行实验,实验现象对应的结论正确的是( )
用下图所示装置进行实验,实验现象对应的结论正确的是( )
 用下图所示装置进行实验,实验现象对应的结论正确的是( )
用下图所示装置进行实验,实验现象对应的结论正确的是( )| a | b | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | c中收集到大量无色气体 | 稀硝酸与铜反应生成NO2 |
| B | 木条 | 18.4mol/L浓硫酸 | 木条变黑 | 浓硫酸具有酸性 |
| C | 铁钉 | 饱和食盐水 | 部分水进入导管 | 铁钉发生吸氧腐蚀 |
| D | 铝片 | 浓硝酸 | 无明显现象 | 铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
18.NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
2.已知某300mLMgCl2与AlCl3的混合液,往其中滴加NaOH溶液,要使沉淀达到最大值,需消耗0.5mol/L的NaOH溶液600mol;则原混合液中c(Cl-)是( )
| A. | 0.5mol/L | B. | 0.8mol/L | C. | 1.0mol/L | D. | 1.5mol/L |
3.下列有机物命名正确的是( )
| A. | 2-乙基丁烷 | B. | 2-乙基-1-丁烯 | ||
| C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  间氯甲苯 间氯甲苯 |