题目内容
下列关于反应热及能量变化的说法正确的是( )
| A、当△H<0时,表示该反应为吸热反应 |
| B、放热反应可以自发进行,而吸热反应需加热才能进行 |
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D、化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、△H<0时,正反应放热;
B、焓变与反应条件无关;
C、△H=生成物的能量和-反应物的能量和;
D、△H=生成物的能量和-反应物的能量和.
B、焓变与反应条件无关;
C、△H=生成物的能量和-反应物的能量和;
D、△H=生成物的能量和-反应物的能量和.
解答:
解:A、△H<0时,正反应放热,故A错误;
B、铝热反应放热,但需要加热到一定温度,故B错误;
C、△H=生成物的能量和-反应物的能量和,故C错误;
D、△H=生成物的能量和-反应物的能量和,所以反应热只与反应体系的始态和终点状态有关,而与反应的途径无关,故D正确;
故选D.
B、铝热反应放热,但需要加热到一定温度,故B错误;
C、△H=生成物的能量和-反应物的能量和,故C错误;
D、△H=生成物的能量和-反应物的能量和,所以反应热只与反应体系的始态和终点状态有关,而与反应的途径无关,故D正确;
故选D.
点评:本题考查了焓变与反应条件无关只决定与反应体系的始态和终点状态,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向一定量的Fe、FeO和Fe2O3的混合物中加入120ml 4mol∕L的稀硝酸,恰好使混合物完全溶解,放出2.24LNO(标况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
| A、0.21mol |
| B、0.24mol |
| C、0.19mol |
| D、0.14mol |
在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是( )
| A、A的百分含量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
在密闭容器中,反应:CH4(g)+H2O(g)?CO(g)+H2(g)△H>0,达到平衡,下列叙述不正确的是( )
| A、增加甲烷的量,△H增大 |
| B、增加水蒸气的量,可提高甲烷的转化率 |
| C、升高温度,逆反应速率增大 |
| D、增大体系压强,该反应的化学平衡常数不变 |
下列关于热化学反应的描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ?mol-1 |
| C、需要加热才能发生的反应一定是吸热反应 |
| D、若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
检验某未知溶液是否含有SO42-离子,你认为合理的方法是( )
| A、先加HNO3再加稀BaCl2溶液 |
| B、先加稀盐酸,再加入BaCl2溶液 |
| C、加入BaCl2溶液 |
| D、加入Ba(NO3)2溶液 |
某盐的混合物中含有0.2mol Na+、0.4mol Mg2+、0.1mol Cl- 和 SO42-,则其含SO42-的物质的量为( )
| A、0.1mol |
| B、0.3mol |
| C、0.5mol |
| D、0.45mol |
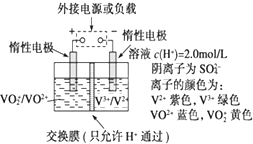 全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.