题目内容
下列依据了化学方程式得出的结论正确的是( )
| A、2SO2(g)+O2(g)?2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则任何中和反应的中和热为-57.3kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
考点:反应热和焓变,反应热的大小比较
专题:
分析:A.放热反应中反应物的总能量大于生成物的总能量;
B.能量越高越不稳定;
C.弱酸电离吸热,其中和热大于-57.3kJ/mol;
D.碳完全燃烧放出的热量多,放热反应的△H为负值.
B.能量越高越不稳定;
C.弱酸电离吸热,其中和热大于-57.3kJ/mol;
D.碳完全燃烧放出的热量多,放热反应的△H为负值.
解答:
解:A.放热反应中反应物的总能量大于生成物的总能量,则2SO2(g)+O2(g)?2SO3(g)为放热反应,SO2和O2的总能量一定高于SO3的能量,故A错误;
B.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石的能量高,能量越高越不稳定,所以石墨比金刚石稳定,故B错误;
C.弱酸电离吸热,其中和热大于-57.3kJ/mol,所以醋酸与氢氧化钠的中和热大于-57.3kJ/mol,故C错误;
D.已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,碳完全燃烧放出的热量多,放热反应的△H为负值,则△H1<△H2,故D正确.
故选D.
B.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石的能量高,能量越高越不稳定,所以石墨比金刚石稳定,故B错误;
C.弱酸电离吸热,其中和热大于-57.3kJ/mol,所以醋酸与氢氧化钠的中和热大于-57.3kJ/mol,故C错误;
D.已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,碳完全燃烧放出的热量多,放热反应的△H为负值,则△H1<△H2,故D正确.
故选D.
点评:本题考查了化学反应与能量变化,主要涉及反应热、物质能量的判断、物质稳定性判断、中和热等,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
氯气可以用来消灭田鼠,使用方法是将氯气通过软管灌入田鼠洞中,这是利用了氯气以下性质中的( )
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤能溶解于水.
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤能溶解于水.
| A、①②③ | B、②③ |
| C、③④ | D、③④⑤ |
H+(aq)+OH-(aq)=H2O(l)△H=a,则a可能等于( )
| A、-57.3mol/L |
| B、-57.3kJ/mol |
| C、+57.3J/mol |
| D、-57.3J/mol |
同温同压下,等质量的O2和CO2相比较,下列叙述正确的是( )
| A、体积比为8:11 |
| B、分子个数之比为11:12 |
| C、物质的量之比为8:11 |
| D、原子个数之比为11:12 |
下列离子方程式书写正确的是( )
| A、稀硫酸跟铁反应:Fe+6H+=2Fe3++3H2↑ |
| B、稀硫酸与氢氧化钡溶液反应:H++OH-=H2O |
| C、碳酸钙放入稀盐酸中:CO32+2H+=CO2↑+H2O |
| D、稀盐酸放入碳酸钠中:CO32+2H+=CO2↑+H2O |
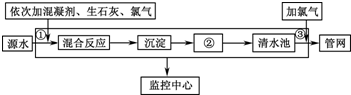 如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.