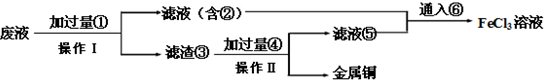
题目内容
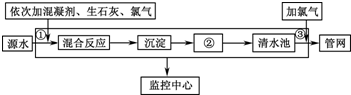 如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.(1)目前我国规定一、二类水质的饮用水中铝含量不得高于0.2mg?L-1.已知常温下Al(OH)3的Ksp=3.2×1034,如果某城市的出厂饮用水的pH为6,则水中Al3+含量为
(2)流程中②的分离方式相当于化学基本操作中的
(3)在污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质[如:Bi3++3H2Dz?Bi(HDz)3+3H+],再经萃取把金属离子从水溶液中分离出来.下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线.它反映了萃取某些金属离子时适宜的pH范围.E%表示某种金属离子以络合物形式被萃取分离的百分率.
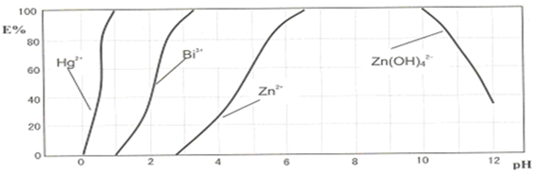
设常温时该反应的化学平衡常数为K,则当pH=2时废水中c(H2Dz)等于
考点:难溶电解质的溶解平衡及沉淀转化的本质,化学平衡的计算,氯气的化学性质
专题:基本概念与基本理论,电离平衡与溶液的pH专题
分析:(1)根据下Al(OH)3的Ksp和溶液中的氢氧根离子的浓度计算;
(2)流程中②的分离目的是分离水与难溶物质;氯气与水反应生成的次氯酸,具有强氧化性;氯气与水反应生成的次氯酸和HCl;
(3)已知方程式Bi3++3H2Dz?Bi(HDz)3+3H+,根据K=
计算.
(2)流程中②的分离目的是分离水与难溶物质;氯气与水反应生成的次氯酸,具有强氧化性;氯气与水反应生成的次氯酸和HCl;
(3)已知方程式Bi3++3H2Dz?Bi(HDz)3+3H+,根据K=
| c[Bi(HDz)3]×c3(H+) |
| c(Bi3+)×c3(H2Dz) |
解答:
解:(1)如果某城市的出厂饮用水的pH为6,则c(OH-)=10-8mol/L,Ksp=c(Al3+)×c3(OH-),则c(Al3+)=
=3.2×10-10mol/L,
设溶液为1L,则其物质的量为3.2×10-10mol,其质量为3.2×10-10mol×27g/mol=8.64×10-9g=8.64×10-6mg,则Al3+的浓度为8.64×10-6mg/L,数值小于0.2mg?L-1,符合标准;
故答案为:8.64×10-6;符合;
(2)流程中②的分离目的是分离水与难溶物质,其操作为过滤;氯气与水反应生成的次氯酸,次氯酸具有强氧化性能杀菌消毒;氯气与水反应生成的次氯酸和HCl,其反应的离子方程式为:Cl2+H2O═H++Cl-+HClO;
故答案为:过滤;消毒杀菌;Cl2+H2O═H++Cl-+HClO;
(3)已知方程式Bi3++3H2Dz?Bi(HDz)3+3H+,pH=2时,c(H+)=10-2mol/L,
设水中的H2Dz的浓度为cmol/L,开始时Bi3+的浓度为amol/L,则平衡时Bi(HDz)3为0.4amol/L,Bi3+为0.6amol/L;
K=
=
,则c=
×10-2mol/L,
故答案为:
×10-2.
| 3.2×10-34 |
| (10-8)3 |
设溶液为1L,则其物质的量为3.2×10-10mol,其质量为3.2×10-10mol×27g/mol=8.64×10-9g=8.64×10-6mg,则Al3+的浓度为8.64×10-6mg/L,数值小于0.2mg?L-1,符合标准;
故答案为:8.64×10-6;符合;
(2)流程中②的分离目的是分离水与难溶物质,其操作为过滤;氯气与水反应生成的次氯酸,次氯酸具有强氧化性能杀菌消毒;氯气与水反应生成的次氯酸和HCl,其反应的离子方程式为:Cl2+H2O═H++Cl-+HClO;
故答案为:过滤;消毒杀菌;Cl2+H2O═H++Cl-+HClO;
(3)已知方程式Bi3++3H2Dz?Bi(HDz)3+3H+,pH=2时,c(H+)=10-2mol/L,
设水中的H2Dz的浓度为cmol/L,开始时Bi3+的浓度为amol/L,则平衡时Bi(HDz)3为0.4amol/L,Bi3+为0.6amol/L;
K=
| c[Bi(HDz)3]×c3(H+) |
| c(Bi3+)×c3(H2Dz) |
| 0.4a×(10-2)3 |
| 0.6a×c3 |
| 3 |
| ||
故答案为:
| 3 |
| ||
点评:本题以污水处理考查离子反应、物质的量浓度的计算、平衡常数的应用等,注重信息的抽取和利用及离子反应方程式的书写的考查,题目难度较大.

练习册系列答案
相关题目
液化石油气的主要成分为丙烷和丁烷,下列有关说法错误的是( )
| A、丙烷和丁烷均属于烷烃 |
| B、两者分子中均含有碳碳双键 |
| C、丙烷和丁烷燃烧均是放热反应 |
| D、丙烷和丁烷充分燃烧均生成二氧化碳和水 |
碘钨灯比白炽灯使用寿命长,灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)
WI2(g)△H<0(温度T1<T2).下列说法正确的是( )
| T1 |
| T2 |
| A、灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上 |
| B、灯丝附近温度越高,WI2(g)的转化率越低 |
| C、温度升高,平衡常数增大 |
| D、利用该反应原理可以提纯钨 |
下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A、C(s)+O2(g)=CO2(g);△H=-315kJ |
| B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3kJ?mol-1 |
| C、C2H5OH+3O2=2CO2+3H2O;△H=-1368.8kJ?mol-1 |
| D、2H2O(g)=2H2(g)+O2(g);△H=-483.6kJ?mol-1 |
下列说法正确的是( )
| A、氧化还原反应中,金属元素被还原一定得到金属单质 |
| B、Ag++Cl-=AgCl↓的反应属于化合反应 |
| C、一种元素化合价升高时必然有另一种元素化合价降低 |
| D、从0.1L0.1mol/L的H2SO4溶液中取出10mL该溶液,其中H+浓度为0.2mol/L |
某元素X的逐级电离能如图表示,下列说法正确的是( )


| A、X元素的化合价可能为+4价 |
| B、X为非金属 |
| C、X为第五周期元素 |
| D、X与氯气反应最可能生成的化合物的化学式可能为XCl3 |
下列依据了化学方程式得出的结论正确的是( )
| A、2SO2(g)+O2(g)?2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则任何中和反应的中和热为-57.3kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |