题目内容
2.一定温度下,在某密闭容器中发生反应:2HI(g)?H2(g)+I2(s)△H>0,若0~15s内c(HI)由0.1mol•L-1降到0.07mol•L-1,则下列说法正确的是( )| A. | 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol•L-1•s-1 | |
| B. | c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间小于10 s | |
| C. | 升高温度正反应速率加快,逆反应速率减慢 | |
| D. | 减小反应体系的体积,化学反应速率加快 |
分析 A.0~15s内c(HI)由0.1mol•L-1降到0.07mol•L-1,v(HI)=$\frac{0.03mol/L}{15s}$=0.002mol/(L.s),结合速率之比等于化学计量数之比计算v(H2);
B.若速率不变,c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间为$\frac{0.02mol/L}{0.002mol/(L.s)}$=10s,但随反应进行浓度减小,反应速率减小;
C.升高温度,正逆反应速率均增大;
D.减小反应体系的体积,压强增大.
解答 解:A.0~15s内c(HI)由0.1mol•L-1降到0.07mol•L-1,v(HI)=$\frac{0.03mol/L}{15s}$=0.002mol/(L.s),由速率之比等于化学计量数之比可知v(H2)=0.002mol/(L.s)×$\frac{1}{2}$=0.001mol/(L.s),但I2(s)为固体,不能表示反应速率,故A错误;
B.若速率不变,c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间为$\frac{0.02mol/L}{0.002mol/(L.s)}$=10s,但随反应进行浓度减小,反应速率减小,则c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间大于10 s,故B错误;
C.升高温度,正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动,故C错误;
D.减小反应体系的体积,压强增大,则化学反应速率加快,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握速率的影响因素及计算方法为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
相关题目
12.某烃分子中含有一个双键和一个叁键,则它的分子式可能是( )
| A. | C4H6 | B. | C5H6 | C. | C7H8 | D. | C10H8 |
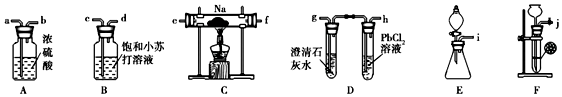
9.苯甲酸乙酯可用作食用香料.某小组用如下装置制备苯甲酸乙酯反应原理:
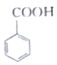 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$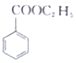 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如表:
实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品.
回答下列问题:
(1)仪器C的名称蒸馏烧瓶.
(2)步骤①若加热后才发现未加沸石,应采取的措施是停止加热,待反应液冷却后,再补加沸石;步骤②采取水浴加热的优点是便于控制温度且受热均匀.
(3)步骤③为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是将B中液体沿器壁缓慢加入水中并不断搅拌.
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有分液漏斗,使用该仪器之前需要进行的操作是检漏;无水MgSO4的作用是作干燥剂.
(5)步骤⑤收集馏分应控制的最佳温度为213℃.
(6)为了提高苯甲酸乙酯的产率,可以采取的措施增大乙醇的用量、对③中水层进行再萃取或适当增加浓H2SO4用量(任填一种).

 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$ (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O产物和部分反应物相关数据如表:
| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品.
回答下列问题:
(1)仪器C的名称蒸馏烧瓶.
(2)步骤①若加热后才发现未加沸石,应采取的措施是停止加热,待反应液冷却后,再补加沸石;步骤②采取水浴加热的优点是便于控制温度且受热均匀.
(3)步骤③为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是将B中液体沿器壁缓慢加入水中并不断搅拌.
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有分液漏斗,使用该仪器之前需要进行的操作是检漏;无水MgSO4的作用是作干燥剂.
(5)步骤⑤收集馏分应控制的最佳温度为213℃.
(6)为了提高苯甲酸乙酯的产率,可以采取的措施增大乙醇的用量、对③中水层进行再萃取或适当增加浓H2SO4用量(任填一种).
14.某学习小组通过实验研究Na2O2与水的反应.
(1)Na2O2的电子式为 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2 并测定其含量.取20.00mL溶液,用稀H2SO4酸化,用0.002mol•L-1 KMnO4溶液滴定,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10.00mL KMnO4溶液.
①实验中,滴定时KMnO4溶液应装在酸(酸或碱)式滴定管中.
②用单线桥标出该反应电子转移的方向和数目:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
③溶液a中c(H2O2)=0.0025mol•L-1.
④溶液褪色速率后阶段变快的原因可能是反应生成的Mn2+作催化剂.
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2 并测定其含量.取20.00mL溶液,用稀H2SO4酸化,用0.002mol•L-1 KMnO4溶液滴定,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10.00mL KMnO4溶液.
①实验中,滴定时KMnO4溶液应装在酸(酸或碱)式滴定管中.
②用单线桥标出该反应电子转移的方向和数目:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
③溶液a中c(H2O2)=0.0025mol•L-1.
④溶液褪色速率后阶段变快的原因可能是反应生成的Mn2+作催化剂.