题目内容
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 28g氮气含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的水分子数为NA | |
| C. | 1molOH-含有的电子数为10NA | |
| D. | 0.1L 1mol/L NaCl溶液中含有Na+个数为NA |
分析 A、氮气由氮原子构成;
B、标况下水为液态;
C、氢氧根中含10个电子;
D、求出氯化钠的物质的量,然后根据1mol氯化钠中含1mol钠离子来分析.
解答 解:A、氮气由氮原子构成,故28g氮气中含有的氮原子的物质的量为n=$\frac{28g}{14g/mol}$=2mol,故含2NA个,故A错误;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、氢氧根中含10个电子,故1mol氢氧根中含10mol电子即10NA个,故C正确;
D、溶液中氯化钠的物质的量n=CV=1mol/L×0.1L=0.1mol,而1mol氯化钠中含1mol钠离子,故0.1mol氯化钠中含0.1mol钠离子即0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.下列反应中,说明氨有还原性和碱性的是( )
| A. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 4NH3+6NO$?_{△}^{催化剂}$5N2+6H2O | D. | NH3+HCl═NH4Cl |
7.下列说法不正确的是( )
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
4.胃药“达喜”中含有碳酸镁(MgCO3).碳酸镁属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
11.我国在全球最先发现天然金属铀.下列对铀元素的一种核素的说法正确的是( )
| A. | 核电荷数为92 | B. | 质子数为143 | C. | 中子数为235 | D. | 核外电子数为235 |
8.如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
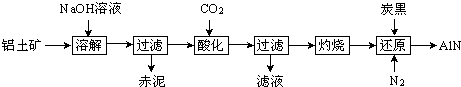
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
赤泥的主要成分为Fe2O3、Na2Al2Si2O8(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为NaHCO3(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示.
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
①该样品中AlN的质量分数为多少?(写出计算过程)
②所用NaOH溶液的浓度为9.5mol/L.

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
赤泥的主要成分为Fe2O3、Na2Al2Si2O8(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为NaHCO3(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示.
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
②所用NaOH溶液的浓度为9.5mol/L.
14.醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+H2O(g)
I.上述反应过程中能量变化如图所示:
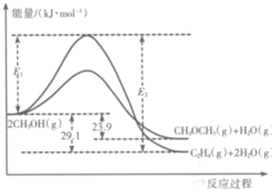
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应ⅰ(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:
E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5 kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器1中平衡时CH3OH(g)的转化率为80%,则该温度下反应i的平衡常数K=4.
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+H2O(g)
I.上述反应过程中能量变化如图所示:

(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应ⅰ(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:
E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5 kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器1中平衡时CH3OH(g)的转化率为80%,则该温度下反应i的平衡常数K=4.
 春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.
春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.