题目内容
下列说法正确的是( )
| A、甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |||
| B、500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
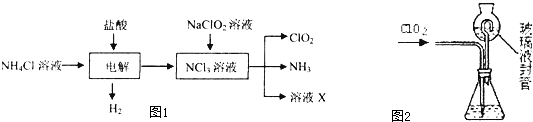
C、 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,由图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
考点:热化学方程式,反应热和焓变
专题:化学反应中的能量变化
分析:A、燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反;
C、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;分析图象中物质的量不符合反应物质物质的量;
D、根据反应热△H=反应物总键能-生成物总键能计算反应热.
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反;
C、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;分析图象中物质的量不符合反应物质物质的量;
D、根据反应热△H=反应物总键能-生成物总键能计算反应热.
解答:
解:A、燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态而不能为气态,故A错误;
B、相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,故B错误;
C、由热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,可知图象中一氧化碳和氧气物质的量为1mol、
mol,物质的量不符合反应物质的物质的量,故C错误;
D、反应热△H=反应物总键能-生成物总键能,所以对于S(s)+3F2(g)═SF6(g),其反应热△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,故D正确
故选:D.
B、相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,故B错误;
C、由热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,可知图象中一氧化碳和氧气物质的量为1mol、
| 1 |
| 2 |
D、反应热△H=反应物总键能-生成物总键能,所以对于S(s)+3F2(g)═SF6(g),其反应热△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,故D正确
故选:D.
点评:本题考查了热化学方程式的计算应用、盖斯定律的应用、燃烧热概念计算分析,热化学方程式的书写方法和计算应用是解题关键,题目难度中等.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
2000年5月,保利集团在香港拍卖会上花费3000万港币购回了在八国联军入侵中国火烧圆明园上后流失的国宝,铜铸的牛首、猴首和虎首.普通的铜器在时间稍久时容易出现铜绿.这三件1760年铜铸的国宝240年后看上去仍然熠熠生辉.下面对其原因的分析中最可能的是( )
| A、它们的表面电镀上了一层耐磨的黄金 |
| B、环境污染日趋严重,它们表面的铜丝被酸雨溶解洗去 |
| C、铜的金属活动性比氢小,因此不易被氧化 |
| D、它们是含有一定比例的金、银、锡、锌的合金 |
下列离子在溶液中可大量共存,形成无色透明溶液的一组是( )
| A、K+、Na+、OH-、Cl- |
| B、Ba2+、Cu2+、NO3-、SO42- |
| C、Mg2+、Na+、OH-、SO42- |
| D、H+、Ba2+、NO3-、OH- |
下列反应中,属于水解反应且使溶液显酸性的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、HCO3-+H2O?CO32-+H3O+ |
| C、S2-+H2O?HS-+OH- |
| D、NH3+H2O?NH4++OH- |
关于电解质的下列说法中正确的是( )
| A、在水溶液中和熔化状态下能导电的化合物 |
| B、在水溶液中或熔化状态下能导电的物质 |
| C、在水溶液中或熔化状态下能导电的化合物 |
| D、在水溶液中或熔化状态下导电的离子由原物质本身电离出来的化合物 |
 向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )| A、a:Cl-; b:K+; c:CO32-; d:HCO3- |
| B、a:K+; b:CO32-; c:Cl-; d:HCO3- |
| C、a:K+; b:CO32-; c:HCO3-; d:Cl- |
| D、a:K+; b:HCO3-;c:Cl-; d:CO32- |