题目内容
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易溶于水.实验室以NH4C1、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图1:
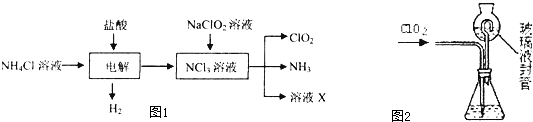
(1)写出电解时发生反应的化学方式: .
(2)测定ClO2(如图2)的过程如下:在锥形瓶中加入足最的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①ClO2通入锥形瓶与酸性碘化钾溶液反应,反应的离子方程式为: .
②装置中玻璃液封管的作用是 、 .
③滴定至终点的现象是 .
④测得ClO2的质量m(ClO2)= .(用含c、V的代数式表示)

(1)写出电解时发生反应的化学方式:
(2)测定ClO2(如图2)的过程如下:在锥形瓶中加入足最的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①ClO2通入锥形瓶与酸性碘化钾溶液反应,反应的离子方程式为:
②装置中玻璃液封管的作用是
③滴定至终点的现象是
④测得ClO2的质量m(ClO2)=
考点:电解原理,中和滴定
专题:实验题,电化学专题
分析:(1)电解时铵根离子失去电子,氢离子得到电子,据此书写电解方程式;
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
③溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
③溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
解答:
解:(1)电解时铵根离子失去电子,氢离子得到电子,电解反应为NH4Cl+2HCl
3H2↑+NCl3,故答案为:NH4Cl+2HCl
3H2↑+NCl3;
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:用水再次吸收残余的二氧化氯气体;使锥形瓶内外压强相等;
③溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点,
故答案为:溶液由蓝色恰好变为无色,且半分钟内不褪色;
④VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c?V?10-3 mol
所以n(ClO2)=
c?V?10-3 mol.
所以m(ClO2)=
c?V?10-3 mol×67.5g/mol=1.35cv×10-2g,
故答案为:1.35cv×10-2g.
| ||
| ||
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:用水再次吸收残余的二氧化氯气体;使锥形瓶内外压强相等;
③溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点,
故答案为:溶液由蓝色恰好变为无色,且半分钟内不褪色;
④VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c?V?10-3 mol
所以n(ClO2)=
| 1 |
| 5 |
所以m(ClO2)=
| 1 |
| 5 |
故答案为:1.35cv×10-2g.
点评:本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.

练习册系列答案
相关题目
青霉氨基酸的结构式如图所示为它不能发生的反应是( )


| A、能与NaOH发生中和反应 |
| B、能与醇发生酯化反应 |
| C、能与盐酸反应生成盐 |
| D、能发生银镜反应 |
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门等.下列性质与这些用途无关的是( )
| A、强度高 | B、不易生锈 |
| C、密度小 | D、导电、导热性好 |
使石蕊试液变红的某透明溶液中,下列各组离子能大量共存的是( )
| A、CO32-、Na+、K+、OH- |
| B、Ba2+、CO32-、NO3-、SO42- |
| C、K+、Cu2+、Cl-、SO42- |
| D、Fe2+、NO3-、Cl-、SO42- |
纤维素被称为“第七营养素”.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.从化学成分看,纤维素是一种( )
| A、多糖 | B、蛋白质 | C、脂肪 | D、油脂 |
①NaHCO3,②Al(OH)3 ③(NH4)2S ④SiO2 ⑤Al五种物质中,跟盐酸和氢氧化钠溶液都能反应的化合物是( )
| A、①②③⑤ | B、只有①②③ |
| C、只有①②③④ | D、全部 |
下列说法正确的是( )
| A、甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |||
| B、500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
C、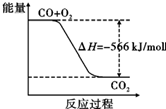 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,由图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
下列属于氧化还原反应的是( )
| A、Cl2+H2O═HCl+HClO |
| B、HCl+NaOH═NaCl+H2O |
| C、NaCl+AgNO3═AgCl↓+NaNO3 |
| D、Cu(OH)2+2HCl═CuCl2+2H2O |
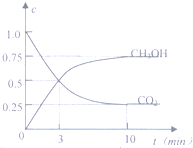 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);
目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);