题目内容
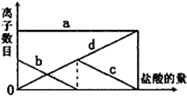 向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )| A、a:Cl-; b:K+; c:CO32-; d:HCO3- |
| B、a:K+; b:CO32-; c:Cl-; d:HCO3- |
| C、a:K+; b:CO32-; c:HCO3-; d:Cl- |
| D、a:K+; b:HCO3-;c:Cl-; d:CO32- |
考点:离子方程式的有关计算
专题:离子反应专题
分析:根据向一定量的K2CO3溶液中缓慢地滴加稀盐酸,则先后发生K2CO3+HCl═KCl+KHCO3、KHCO3+HCl═KCl+CO2↑+H2O,则钾离子数目不发生变化,氯离子的数目在增加,碳酸根离子的数目一直在减少,直到为0,碳酸氢根离子的数目先增大后减小,直到为0,然后结合图象来分析对应的离子.
解答:
解:因向一定量的K2CO3溶液中缓慢地滴加稀盐酸,先后发生如下反应,
K2CO3+HCl═KCl+KHCO3、KHCO3+HCl═KCl+CO2↑+H2O,
则钾离子的数目不变,即图中a为K+离子,
碳酸根离子在减少,直至为0,即图中b为CO32-离子,
碳酸氢根离子先增大后减小,直至为0,即图中c为HCO3-离子,
氯离子先为0,随盐酸的加入氯离子的数目在增多,即图中d为Cl-离子,
故选C.
K2CO3+HCl═KCl+KHCO3、KHCO3+HCl═KCl+CO2↑+H2O,
则钾离子的数目不变,即图中a为K+离子,
碳酸根离子在减少,直至为0,即图中b为CO32-离子,
碳酸氢根离子先增大后减小,直至为0,即图中c为HCO3-离子,
氯离子先为0,随盐酸的加入氯离子的数目在增多,即图中d为Cl-离子,
故选C.
点评:本题以碳酸钠与盐酸的反应来分析溶液中离子的变化,明确离子反应的实质并学会结合图象来判断离子数目是解答的关键,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列说法正确的是( )
| A、甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |||
| B、500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
C、 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,由图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
下列属于氧化还原反应的是( )
| A、Cl2+H2O═HCl+HClO |
| B、HCl+NaOH═NaCl+H2O |
| C、NaCl+AgNO3═AgCl↓+NaNO3 |
| D、Cu(OH)2+2HCl═CuCl2+2H2O |
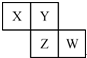 短周期元素X、Y、Z、W在元素周期表中的相对位置如图,其中Y与Z可形成化合物ZY2,且Y、Z元素的质量分数都是50%.下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图,其中Y与Z可形成化合物ZY2,且Y、Z元素的质量分数都是50%.下列说法正确的是( )| A、元素Y和元素Z的最高正化合价相同 |
| B、第一电离能:Y>X,W>Z |
| C、气态氢化物的热稳定性顺序为X<Y<Z |
| D、元素W的最高价氧化物对应水化物的酸性最强 |
臭氧(O3)氧化性很强,下列物质:(1)SO2;(2)CO2;(3)CO;(4)N2;(5)氟里昂(CCl2F2);(6)NO中,能破坏大气臭氧层的是( )
| A、(1)(3)(5) |
| B、(1)(3)(5)(6) |
| C、(1)(2)(3)(5(6) |
| D、全部 |
下列实验能证明SO2存在的是( )
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成.
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成.
| A、都不能证明 |
| B、③④⑤能证明 |
| C、③⑤能证明 |
| D、只有⑤能证明 |
下列电离方程式中,正确的是( )
| A、Ca(OH)2═Ca2++2(OH)- |
| B、FeCl2═Fe2++3Cl- |
| C、H2SO4═H++SO42- |
| D、Al2(SO4)3═2Al3++3SO42- |