题目内容
测定弱电解质溶液的电导率可确定电解质的强弱及电离常数
(1)已知H2SO3的Ka1=1.54×10-2,Ka2=6.6×10-8;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11
下列反应不能进行的是
a.HSO3-+HCO3-═SO32-+H2CO3
b.SO2+HCO3-═HSO3-+CO2
c.HSO3-+CO32-═HCO3-+SO32-
d.2H2SO3+CO32--═2HSO3-+CO2↑
(2)常用电导法测量空气中的二氧化碳的浓度,为了减小分析误差,要求所用吸收液吸收容量尽可能大,误差尽可能小,下列物质最适合用作二氧化碳吸收液的是
a.硫酸溶液 b溴水 c.氢氧化钠溶液 d.食盐溶液
(3)若测得0.5mol?L-1Pb(NO3)2溶液导电能力远远比同浓度的(CH3COO)2Pb溶液导电能力强,则:
①写出醋酸铅的电离方程式
②PbSO4不溶于水和稀硝酸,但能溶于较浓的醋酸,得到无色透明的溶液,导电能力显著增强,向无色溶液中通入H2S气体,又生成黑色沉淀,溶液的导电能力稍有增强,请写出有关反应离子方程式来解释上述实验现象 .
(1)已知H2SO3的Ka1=1.54×10-2,Ka2=6.6×10-8;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11
下列反应不能进行的是
a.HSO3-+HCO3-═SO32-+H2CO3
b.SO2+HCO3-═HSO3-+CO2
c.HSO3-+CO32-═HCO3-+SO32-
d.2H2SO3+CO32--═2HSO3-+CO2↑
(2)常用电导法测量空气中的二氧化碳的浓度,为了减小分析误差,要求所用吸收液吸收容量尽可能大,误差尽可能小,下列物质最适合用作二氧化碳吸收液的是
a.硫酸溶液 b溴水 c.氢氧化钠溶液 d.食盐溶液
(3)若测得0.5mol?L-1Pb(NO3)2溶液导电能力远远比同浓度的(CH3COO)2Pb溶液导电能力强,则:
①写出醋酸铅的电离方程式
②PbSO4不溶于水和稀硝酸,但能溶于较浓的醋酸,得到无色透明的溶液,导电能力显著增强,向无色溶液中通入H2S气体,又生成黑色沉淀,溶液的导电能力稍有增强,请写出有关反应离子方程式来解释上述实验现象
考点:弱电解质在水溶液中的电离平衡,离子方程式的书写,电离方程式的书写
专题:
分析:(1)依据电离常数大小判断H2SO3、HSO3-、H2CO3、HCO3-酸性强弱,依据强酸制备弱酸的原理判断反应能否发生,据此解答;
(2)根据二氧化碳在该溶液中的溶解性判断;
(3)①若测得0.5mol?L-1Pb(NO3)2溶液导电能力远远比同浓度的(CH3COO)2Pb溶液导电能力强,说明(CH3COO)2Pb在溶液中部分电离,为弱电解质;
②PbSO4溶于浓醋酸,会生成弱电解质(CH3COO)2Pb,同时还有H2SO4生成,离子浓度增大,导电能力增强,当加入H2S气体时,生成黑色沉淀PbS,同时还有CH3COOH 生成,所以溶液导电能力稍有增强.
(2)根据二氧化碳在该溶液中的溶解性判断;
(3)①若测得0.5mol?L-1Pb(NO3)2溶液导电能力远远比同浓度的(CH3COO)2Pb溶液导电能力强,说明(CH3COO)2Pb在溶液中部分电离,为弱电解质;
②PbSO4溶于浓醋酸,会生成弱电解质(CH3COO)2Pb,同时还有H2SO4生成,离子浓度增大,导电能力增强,当加入H2S气体时,生成黑色沉淀PbS,同时还有CH3COOH 生成,所以溶液导电能力稍有增强.
解答:
解:(1)H2SO3的Ka1=1.54×10-2,Ka2=6.6×10-8;H2CO3的K′a1=4.2×10-7,K′a2=5.6×10-11,所以H2SO3、HSO3-、H2CO3、HCO3-酸性由强到弱的顺序为:H2SO3、H2CO3、HSO3-、HCO3-,依据强酸制备弱酸的原理判断,
A.H2CO3酸性强于HSO3-,所以HSO3-+HCO3-=SO32-+H2CO3不正确,故A错误;
B.二氧化硫溶与水生成H2SO3,过量亚硫酸与碳酸氢根离子反应生成二氧化碳和亚硫酸氢根离子,故B正确;
C.HSO3-酸性强于HCO3-,所以HSO3-+CO32-=HCO3-+SO32-能够反应,故C正确;
D.H2SO3酸性强于H2CO3,2H2SO3 +CO32-=2HSO3-+CO2↑能够发生,故D正确;
故答案为:A;
(2)常用电导法测量空气中的二氧化碳的浓度,为了减小分析误差,要求所用吸收液吸收容量尽可能大,
a.二氧化碳在硫酸溶液中的溶解度很小,所以不适合吸收液,故a不选;
b.二氧化碳在溴水溶液中的溶解度很小,所以不适合吸收液,故b不选;
c.二氧化碳与氢氧化钠溶液反应生成碳酸钠或碳酸氢钠,则二氧化碳容易被氢氧化钠容易吸收,故c选;
d.二氧化碳在食盐溶液溶液中的溶解度较小,所以不适合吸收液,故d不选;
故答案为:c;
(3)①若测得0.5mol?L-1Pb(NO3)2溶液导电能力远远比同浓度的(CH3COO)2Pb溶液导电能力强,说明(CH3COO)2Pb在溶液中部分电离,为弱电解质,则其电离方程式为:(CH3COO)2Pb?2CH3COO-+Pb2+;
故答案为:(CH3COO)2Pb?2CH3COO-+Pb2+;
②PbSO4溶于浓醋酸,发生反应:PbSO4+2CH3COOH═(CH3COO)2Pb+2H++SO42-,PbSO4难溶,与CH3COOH弱电解质反应后生成的H2SO4是强电解质,完全电离,离子浓度显著增大,所以导电性增强;当加入H2S气体时,生成黑色沉淀PbS,发生反应:(CH3COO)2Pb+H2S═PbS↓+2CH3COOH,CH3COOH比(CH3COO)2Pb易电离,离子浓度增大,所以导电性增强;
故答案为:PbSO4+2CH3COOH═(CH3COO)2Pb+2H++SO42-,PbSO4难溶,与CH3COOH弱电解质反应后生成的H2SO4是强电解质,完全电离,离子浓度显著增大;(CH3COO)2Pb+H2S═PbS↓+2CH3COOH,CH3COOH比(CH3COO)2Pb易电离,离子浓度增大.
A.H2CO3酸性强于HSO3-,所以HSO3-+HCO3-=SO32-+H2CO3不正确,故A错误;
B.二氧化硫溶与水生成H2SO3,过量亚硫酸与碳酸氢根离子反应生成二氧化碳和亚硫酸氢根离子,故B正确;
C.HSO3-酸性强于HCO3-,所以HSO3-+CO32-=HCO3-+SO32-能够反应,故C正确;
D.H2SO3酸性强于H2CO3,2H2SO3 +CO32-=2HSO3-+CO2↑能够发生,故D正确;
故答案为:A;
(2)常用电导法测量空气中的二氧化碳的浓度,为了减小分析误差,要求所用吸收液吸收容量尽可能大,
a.二氧化碳在硫酸溶液中的溶解度很小,所以不适合吸收液,故a不选;
b.二氧化碳在溴水溶液中的溶解度很小,所以不适合吸收液,故b不选;
c.二氧化碳与氢氧化钠溶液反应生成碳酸钠或碳酸氢钠,则二氧化碳容易被氢氧化钠容易吸收,故c选;
d.二氧化碳在食盐溶液溶液中的溶解度较小,所以不适合吸收液,故d不选;
故答案为:c;
(3)①若测得0.5mol?L-1Pb(NO3)2溶液导电能力远远比同浓度的(CH3COO)2Pb溶液导电能力强,说明(CH3COO)2Pb在溶液中部分电离,为弱电解质,则其电离方程式为:(CH3COO)2Pb?2CH3COO-+Pb2+;
故答案为:(CH3COO)2Pb?2CH3COO-+Pb2+;
②PbSO4溶于浓醋酸,发生反应:PbSO4+2CH3COOH═(CH3COO)2Pb+2H++SO42-,PbSO4难溶,与CH3COOH弱电解质反应后生成的H2SO4是强电解质,完全电离,离子浓度显著增大,所以导电性增强;当加入H2S气体时,生成黑色沉淀PbS,发生反应:(CH3COO)2Pb+H2S═PbS↓+2CH3COOH,CH3COOH比(CH3COO)2Pb易电离,离子浓度增大,所以导电性增强;
故答案为:PbSO4+2CH3COOH═(CH3COO)2Pb+2H++SO42-,PbSO4难溶,与CH3COOH弱电解质反应后生成的H2SO4是强电解质,完全电离,离子浓度显著增大;(CH3COO)2Pb+H2S═PbS↓+2CH3COOH,CH3COOH比(CH3COO)2Pb易电离,离子浓度增大.
点评:本题考查了电离常数的应用、弱电解质的电离平衡的应用、溶液的导电性等,明确电离常数的意义是解题关键,题目难度中等.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
下列各组物质既不是同系物又不是同分异构体的是( )
| A、软脂酸和硬脂酸 |
| B、甲酸甲酯和乙酸 |
| C、油酸和乙酸 |
| D、对甲基苯酚和苯甲醇 |
使石蕊试液变红的某透明溶液中,下列各组离子能大量共存的是( )
| A、CO32-、Na+、K+、OH- |
| B、Ba2+、CO32-、NO3-、SO42- |
| C、K+、Cu2+、Cl-、SO42- |
| D、Fe2+、NO3-、Cl-、SO42- |
①NaHCO3,②Al(OH)3 ③(NH4)2S ④SiO2 ⑤Al五种物质中,跟盐酸和氢氧化钠溶液都能反应的化合物是( )
| A、①②③⑤ | B、只有①②③ |
| C、只有①②③④ | D、全部 |
下列说法正确的是( )
| A、甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |||
| B、500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
C、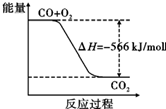 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,由图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
在强酸性溶液中,可以大量共存的离子组是( )
| A、Na+、K+、CH3COO-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Na+、Ag+、SO42-、Cl- |
| D、Al3+、Fe3+、NO3-、SO42- |
在用Zn、Cu片和CuSO4溶液组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
| A、锌片是正极,铜片质量不变 |
| B、电流方向是从锌片流向铜片 |
| C、锌片是负极,铜片质量不变 |
| D、锌片是负极,铜片质量增加 |
臭氧(O3)氧化性很强,下列物质:(1)SO2;(2)CO2;(3)CO;(4)N2;(5)氟里昂(CCl2F2);(6)NO中,能破坏大气臭氧层的是( )
| A、(1)(3)(5) |
| B、(1)(3)(5)(6) |
| C、(1)(2)(3)(5(6) |
| D、全部 |