题目内容
下列反应中,属于水解反应且使溶液显酸性的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、HCO3-+H2O?CO32-+H3O+ |
| C、S2-+H2O?HS-+OH- |
| D、NH3+H2O?NH4++OH- |
考点:盐类水解的原理,影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:水解反应的概念:在溶液中盐电离出的离子与水电离出的氢离子和氢氧根结合生成弱电解质的反应.
A、铵离子的水解,溶液显示酸性;
B、属于碳酸氢根的电离方式是;
C、是水解反应,溶液显示碱性;
D、氨水的电离方程式.
A、铵离子的水解,溶液显示酸性;
B、属于碳酸氢根的电离方式是;
C、是水解反应,溶液显示碱性;
D、氨水的电离方程式.
解答:
解:在溶液中盐电离出的离子与水电离出的氢离子和氢氧根结合生成弱电解质的反应是水解反应,
A、铵离子是弱碱根离子,结合水电离的氢氧根,溶液显示酸性,故A正确;
B、该反应是碳酸氢根的电离方程式,故B错误;
C、该反应是S2-的水解方程式,溶液呈碱性,故C错误;
D、氨气和水生成氨水,该反应不是水解方程式,也不是一水合氨的电离,故D错误.
故选A.
A、铵离子是弱碱根离子,结合水电离的氢氧根,溶液显示酸性,故A正确;
B、该反应是碳酸氢根的电离方程式,故B错误;
C、该反应是S2-的水解方程式,溶液呈碱性,故C错误;
D、氨气和水生成氨水,该反应不是水解方程式,也不是一水合氨的电离,故D错误.
故选A.
点评:本题考查水解原理,水解反应的概念是在溶液中盐电离出的离子与水电离出的氢离子和氢氧根结合生成弱电解质的反应,难度不高.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
①NaHCO3,②Al(OH)3 ③(NH4)2S ④SiO2 ⑤Al五种物质中,跟盐酸和氢氧化钠溶液都能反应的化合物是( )
| A、①②③⑤ | B、只有①②③ |
| C、只有①②③④ | D、全部 |
下列说法正确的是( )
| A、甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |||
| B、500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
C、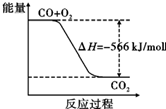 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,由图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
在强酸性溶液中,可以大量共存的离子组是( )
| A、Na+、K+、CH3COO-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Na+、Ag+、SO42-、Cl- |
| D、Al3+、Fe3+、NO3-、SO42- |
可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时负极附近溶液的碱性不变 |
| B、充电过程是化学能转化为电能的过程 |
| C、充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
| D、放电时电解质溶液中的OH-向正极移动 |
在用Zn、Cu片和CuSO4溶液组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
| A、锌片是正极,铜片质量不变 |
| B、电流方向是从锌片流向铜片 |
| C、锌片是负极,铜片质量不变 |
| D、锌片是负极,铜片质量增加 |
下列属于氧化还原反应的是( )
| A、Cl2+H2O═HCl+HClO |
| B、HCl+NaOH═NaCl+H2O |
| C、NaCl+AgNO3═AgCl↓+NaNO3 |
| D、Cu(OH)2+2HCl═CuCl2+2H2O |
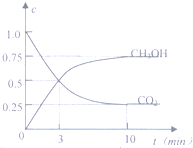 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);
目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);