题目内容
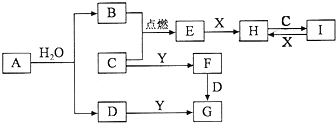 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.请回答下列问题:
(1)F的化学式为
(2)E的电子式为
(3)写出Y和D溶液反应的离子方程式:
(4)写出C与H溶液反应的化学方程式,并用单线桥标出电子转移的方向和数目:
考点:无机物的推断
专题:推断题
分析:金属Y既能与强酸反应,又能与强碱反应,则Y为Al;G的焰色反应显黄色,含有Na元素,结合转化关系,由元素守恒可知金属A为Na,与水反应生成D与气体B,则B为H2、D为NaOH,I的溶液呈黄色,结合转化关系可知,含有Fe3+,则金属X为Fe,气体C具有强氧化性,可推知C为Cl2,则E为HCl、H为FeCl2,I为FeCl3,C与Y反应生成F为AlCl3,由于F与D反应生成G,且D与Y反应也得到G,故G为NaAlO2,据此解答.
解答:
解:金属Y既能与强酸反应,又能与强碱反应,则Y为Al;G的焰色反应显黄色,含有Na元素,结合转化关系,由元素守恒可知金属A为Na,与水反应生成D与气体B,则B为H2、D为NaOH,I的溶液呈黄色,结合转化关系可知,含有Fe3+,则金属X为Fe,气体C具有强氧化性,可推知C为Cl2,则E为HCl、H为FeCl2,I为FeCl3,C与Y反应生成F为AlCl3,由于F与D反应生成G,且D与Y反应也得到G,故G为NaAlO2,
(1)由上述分析可知,F的化学式为AlCl3,故答案为:AlCl3;
(2)E为HCl,其电子式为 ,故答案为:
,故答案为: ;
;
(3)Y和D溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)C与H溶液反应是氯化亚铁与氯气反应生成氯化铁,用单线桥标出电子转移的方向和数目为: ,故答案为:
,故答案为: .
.
(1)由上述分析可知,F的化学式为AlCl3,故答案为:AlCl3;
(2)E为HCl,其电子式为
 ,故答案为:
,故答案为: ;
;(3)Y和D溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)C与H溶液反应是氯化亚铁与氯气反应生成氯化铁,用单线桥标出电子转移的方向和数目为:
 ,故答案为:
,故答案为: .
.
点评:本题考查无机物推断,涉及Fe、Al、Cl元素单质化合物知识,Y的性质及G的焰色反应、I的溶液呈黄色等是推断突破口,难度中等.

练习册系列答案
相关题目
下列反应属于氧化还原反应的是( )
| A、H2+CuO═Cu+H2O |
| B、Na2 O+H2O═2 NaOH |
| C、CaCO3═CaO+CO2↑ |
| D、KOH+HNO3═KNO3+H2O |
下列烷烃的一氯取代产物中没有同分异构体的是( )
| A、CH3一CH2一CH2一CH3 |
B、 |
| C、CH3一CH2一CH3 |
| D、CH3一CH3 |
 如图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色.F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色.图中的部分反应产物或反应物已略去.
如图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色.F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色.图中的部分反应产物或反应物已略去. 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿 一定条件下将2.3mol SO2气体和1.2mol O2气体充入一容积可变的密闭容器中,可滑动活塞的位置如图1所示,在恒温恒压下发生如下反应:2SO2(g)+O2(g)?2SO3(g),其中△H<0,当反应达到平衡时,活塞位置如图2所示.
一定条件下将2.3mol SO2气体和1.2mol O2气体充入一容积可变的密闭容器中,可滑动活塞的位置如图1所示,在恒温恒压下发生如下反应:2SO2(g)+O2(g)?2SO3(g),其中△H<0,当反应达到平衡时,活塞位置如图2所示.