题目内容
 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl
此反应自伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
(1)在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
| 实验 序号 |
温度℃ | 初始CCl4浓度 (mol?L-1) |
初始H2浓度(mol?L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
②实验l中,CCl4的转化率A
③实验2中,10h后达到平衡,H2的平均反应速率为
④实验3中,B的值
A.等于50% B.大于50%
C.小于50% D.从本题资料,无法判断
(2)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol?L一1和4mol?L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).
①在图中的四条线中,表示H2起始浓度为2mol?L一1实验的消耗CCl4的百分率变化曲线是
②根据上图曲线,氢气的起始浓度为
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1))①化学平衡常数指一定温度下,可逆反应到达平衡时生成物浓度化学计量数次数幂之积与生成物浓度化学计量数次数幂之积的比值;
根据三段式计算出各物质的平衡浓度,再代入平衡常数的表达式计算;
②令平衡时CCl4浓度变化量为amol/L,利用三段式表示出平衡时各组分的浓度,再利用平衡常数列方程计算,进而计算CCl4的转化率;
③计算氢气的浓度变化量,再根据v(H2)=
计算;浓度商Qc=
,与平衡常数比较,判断反应移动方向;
④对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小;
(2)①氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,据此判断;
②由图象可知,氢气的浓度为4mol/L,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高.
根据三段式计算出各物质的平衡浓度,再代入平衡常数的表达式计算;
②令平衡时CCl4浓度变化量为amol/L,利用三段式表示出平衡时各组分的浓度,再利用平衡常数列方程计算,进而计算CCl4的转化率;
③计算氢气的浓度变化量,再根据v(H2)=
| △c |
| △t |
| c(CHCl3)×c(HCl) |
| c(CCl4)×c(H2) |
④对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小;
(2)①氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,据此判断;
②由图象可知,氢气的浓度为4mol/L,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高.
解答:
解:(1)①因CCl4的沸点为77℃,CHCl3的沸点为61.2℃,所以在110℃或100℃反应时各物质均为气态,其平衡常数K=
;
110℃时,实验2中,10h后达到平衡,CCl4的转化率为50%,平衡时氢气的浓度变化量=1mol/L×50%=0.5mol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L):1 1 0 0
变化(mol/L):0.5 0.5 0.5 0.5
平衡(mol/L):0.5 0.5 0.5 0.5
则平衡常数k=
=1,
故答案为:
;1;
②实验1中,设平衡时四氯化碳的浓度变化量为amol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则
=1,解得a=0.48,则CCl4的转化率为
×100%=60%>50%,
故答案为:大于;
③平衡时氢气的浓度变化量=1mol/L×50%=0.5mol/L,则v(H2)=
=0.05mol/(L?h),
在此实验的平衡体系中,再加入0.5mol CCl4和1.0mol HCl,此时浓度商Qc=
,大于平衡常数1,则平衡逆向进行,
故答案为:0.05mol/(L?h);逆反应;
④对于实验3,因温度与实验1、2不同,又不知该反应的热效应,所以无法判断转化率的大小,
故答案为:D;
(2)①由图象可知,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是③;
故答案为:c;
②由图象可知,4 mol?L-1的①、②曲线比2mol?L-1③、④曲线CCl4转化率和产物中CHCl3的百分率的数值均高,
故答案为:4;从图中可见,4 mol?L-1的①、②曲线比2mol?L-1③、④曲线CCl4转化率和产物中CHCl3的百分率的数值均高.
| c(CHCl3)×c(HCl) |
| c(CCl4)×c(H2) |
110℃时,实验2中,10h后达到平衡,CCl4的转化率为50%,平衡时氢气的浓度变化量=1mol/L×50%=0.5mol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L):1 1 0 0
变化(mol/L):0.5 0.5 0.5 0.5
平衡(mol/L):0.5 0.5 0.5 0.5
则平衡常数k=
| 0.5×0.5 |
| 0.5×0.5 |
故答案为:
| c(CHCl3)×c(HCl) |
| c(CCl4)×c(H2) |
②实验1中,设平衡时四氯化碳的浓度变化量为amol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则
| a×a |
| (0.8-a)×(1.2-a) |
| 0.48mol/L |
| 0.8mol/L |
故答案为:大于;
③平衡时氢气的浓度变化量=1mol/L×50%=0.5mol/L,则v(H2)=
| 0.5mol/L |
| 10h |
在此实验的平衡体系中,再加入0.5mol CCl4和1.0mol HCl,此时浓度商Qc=
| c(CHCl3)×c(HCl) |
| c(CCl4)×c(H2) |
故答案为:0.05mol/(L?h);逆反应;
④对于实验3,因温度与实验1、2不同,又不知该反应的热效应,所以无法判断转化率的大小,
故答案为:D;
(2)①由图象可知,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是③;
故答案为:c;
②由图象可知,4 mol?L-1的①、②曲线比2mol?L-1③、④曲线CCl4转化率和产物中CHCl3的百分率的数值均高,
故答案为:4;从图中可见,4 mol?L-1的①、②曲线比2mol?L-1③、④曲线CCl4转化率和产物中CHCl3的百分率的数值均高.
点评:本题考查化学平衡计算、化学反应速率计算、化学平衡常数计算与应用、影响化学平衡的因素,难度中等,注意掌握三段式计算与平衡常数的应用.

练习册系列答案
相关题目
过氧化氢溶液在下列条件下分别发生分解反应,开始反应时反应速率最大的是( )
| 温度 | 溶质质量分数 | 有无催化剂(MnO2) | |
| A | 25℃ | 5% | 有 |
| B | 25℃ | 5% | 无 |
| C | 40℃ | 10% | 有 |
| D | 40℃ | 10% | 无 |
| A、A | B、B | C、C | D、D |
下列物质中属于盐类的是( )
| A、MgO |
| B、H2SO4 |
| C、Ca(OH)2 |
| D、Na2CO3 |
下列分类不正确的是( )
| A、纯碱、烧碱均属于碱类 |
| B、CO2、SiO2、SO2均属于酸性氧化物 |
| C、醋酸、硫酸、硝酸均属于酸类 |
| D、Na2CO3、Na2SO3、NaCl均属于钠盐 |
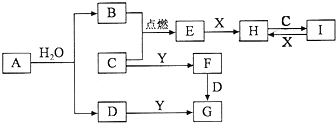 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
 b.
b. c.
c.
 b.
b. c.
c.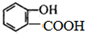
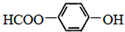
 的名称为
的名称为 核磁共振氢谱有
核磁共振氢谱有 .
.