题目内容
浓硫酸敞口放置在空气中浓度会变稀这是因为浓硫酸具有 性;浓硝酸敞口放置在空气中浓度会变稀是因为浓硝酸具有 性;金属镁与稀硝酸反应主要不生成氢气,是因为稀硝酸具有 性;在浓硫酸存在下,浓硝酸与苯反应生成硝基苯,该反应类型属于 反应.
考点:浓硫酸的性质,硝酸的化学性质
专题:元素及其化合物
分析:浓硫酸具有吸水性,浓硝酸易挥发,具有强氧化性,与活泼金属反应不生成氢气,在浓硫酸作用下,可与苯发生取代反应生成硝基苯,以此解答.
解答:
解:浓硫酸具有吸水性,防止在空气中因吸水而导致浓度变小,浓硝酸易挥发,在空气中浓度变小,具有强氧化性,与活泼金属反应不生成氢气,在浓硫酸作用下,可与苯发生取代反应生成硝基苯,
故答案为:吸水;挥发;强氧化;取代.
故答案为:吸水;挥发;强氧化;取代.
点评:本题综合考查浓硫酸和硝酸的性质,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意常见物质的性质的掌握,难度不大.

练习册系列答案
相关题目
互为同素异形体的是( )
| A、168O与188O |
| B、CH4与C2H6 |
| C、红磷与白磷 |
| D、正丁烷与异丁烷 |
下列反应的离子方程式正确的是( )
A、电解饱和食盐水 2Cl-+2H+
| ||||
| B、足量二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O=2HCO3- | ||||
| C、稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | ||||
| D、碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
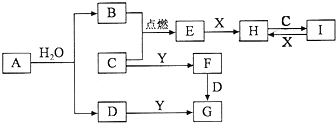 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色. 在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示.试填写下列空白:
在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示.试填写下列空白: b.
b. c.
c.
 b.
b. c.
c.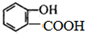
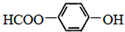
 的名称为
的名称为 核磁共振氢谱有
核磁共振氢谱有 .
. 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.
一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.