题目内容
氢气是一种高效而没有污染的能源.
(1)氢气在氧气中燃烧生成1mol水蒸汽,同时放出热量241.8KJ/mol.写出该反应的热化学方程式: .
(2)在一定条件下,将H2和CO2放在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g)
①该反应的化学平衡常数表达式为K=
②判断该反应是否达到化学平衡的依据是 (多选扣分)
a.容器内压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(1)氢气在氧气中燃烧生成1mol水蒸汽,同时放出热量241.8KJ/mol.写出该反应的热化学方程式:
(2)在一定条件下,将H2和CO2放在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g)
①该反应的化学平衡常数表达式为K=
②判断该反应是否达到化学平衡的依据是
a.容器内压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
考点:热化学方程式,化学平衡常数的含义,化学平衡状态的判断
专题:化学反应中的能量变化,化学平衡专题
分析:(1)书写热化学方程式时,物质的状态影响到物质所具有的能量,所以必须标上物质的状态,而且物质的计量数要和放出或吸收的热量成比例;
(2)①依据平衡常数概念书写,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②化学反应达到平衡状态的标志是正逆反应速率相同,个组分含量保持不变,即”变量不变”是判断依据.
(2)①依据平衡常数概念书写,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②化学反应达到平衡状态的标志是正逆反应速率相同,个组分含量保持不变,即”变量不变”是判断依据.
解答:
解:(1)氢气在氧气中燃烧生成1mol水蒸汽,同时放出热量241.8KJ/mol,反应的热化学方程式为:H2(g)+
O2(g)=H2O(g);△H=-241.8 kJ/mol;
故答案为:H2(g)+
O2(g)=H2O(g);△H=-241.8 kJ/mol;
(2)①CO2(g)+H2(g)?CO(g)+H2O(g),依据平衡常数的概念书写得到K=
;
故答案为:
;
②CO2(g)+H2(g)?CO(g)+H2O(g),反应是气体体积不变的反应
a.反应前后气体体积不变,反应过程中和平衡状态下容器内压强始终不变,不能说明反应达到平衡状态,故a不符合;
b.混合气体中c(CO)不变是浓度不变,是化学平衡的标志,故b符合;
c.化学反应速率之比等于化学方程式计量数之比为正反应速率之比,v正(H2)=v逆(H2O),说明水的正逆反应速率相同,故C符合;
d.物质的浓度相同和起始量变化量有关,c(CO2)=c(CO)浓度相同不能说明反应达到平衡状态,故d不符合;
故选bc
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(2)①CO2(g)+H2(g)?CO(g)+H2O(g),依据平衡常数的概念书写得到K=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
故答案为:
| c(CO)c(H2O) |
| c(CO2)c(H2) |
②CO2(g)+H2(g)?CO(g)+H2O(g),反应是气体体积不变的反应
a.反应前后气体体积不变,反应过程中和平衡状态下容器内压强始终不变,不能说明反应达到平衡状态,故a不符合;
b.混合气体中c(CO)不变是浓度不变,是化学平衡的标志,故b符合;
c.化学反应速率之比等于化学方程式计量数之比为正反应速率之比,v正(H2)=v逆(H2O),说明水的正逆反应速率相同,故C符合;
d.物质的浓度相同和起始量变化量有关,c(CO2)=c(CO)浓度相同不能说明反应达到平衡状态,故d不符合;
故选bc
点评:本题考查了化学平衡状态的分析判断,热化学方程式书写,平衡常数的概念理解,掌握基础是关键,题目较简单.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
互为同素异形体的是( )
| A、168O与188O |
| B、CH4与C2H6 |
| C、红磷与白磷 |
| D、正丁烷与异丁烷 |


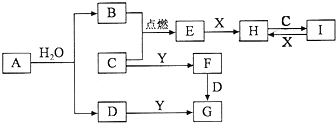 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色. 在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示.试填写下列空白:
在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示.试填写下列空白: