题目内容
5.把0.6mol X气体和0.6mol Y气体混合于2L体积不变的密闭容器中,使它们发生如下反应:2X(g)+Y(g)=4Z(g)+2W(g).2min末生成0.2mol W.计算:(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末Y的物质的量浓度.
分析 (1)根据生成的0.2molW,利用物质的量之比等于化学计量数之比,求出参加反应的X的物质的量,再结合V=$\frac{△c}{△t}$;
(2)根据生成的0.2molW,利用物质的量之比等于化学计量数之比,求出参加反应的Y的物质的量,再计算出2min末剩余的Y的物质的量,利用浓度定义计算.
解答 解:(1)2min末已生成W的物质的量为n(W)=0.2mol
物质的量之比等于化学计量数之比,所以参加反应的X的物质的量n(X)=$\frac{2}{2}$n(W)=0.2mol,
所以前2min内用X的浓度变化表示的平均反应速率=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05m ol/(L•min),
答:2min内用X的浓度变化表示的平均反应速率为0.05m ol/(L•min);
(2)2min末已生成W的物质的量为n(W)=0.2mol
物质的量之比等于化学计量数之比,所以参加反应的Y的物质的量n(Y)=$\frac{1}{2}$n(W)=$\frac{1}{2}$×0.2mol=0.1mol,
所以2min末剩余的Y的物质的量为0.6mol-0.1mol=0.5mol
2min末时Y的浓度为$\frac{0.5mol}{2L}$=0.25mol/L,
答:2min末Y的物质的量浓度为0.25mol/L.
点评 本题考查化学平衡计算,难度不大,熟练掌握基础知识,注意反应物与生成物的变化量与化学计量数成正比,这是易错点,也是解题关键要点.

练习册系列答案
相关题目
2.如图是实验室制备氯气并进行一系列相关实验的装置(夹持仪器已略).
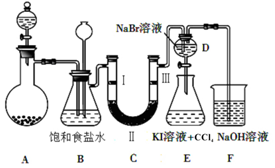
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,图示装置还缺少的一种仪器为酒精灯.装置B中饱和食盐水的作用是除去Cl2中的HCl气体;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d(填字母).
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱. 当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为黄色,打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,下层(苯层)为紫红色.
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:2OH-+Cl2=Cl-+ClO-+H2O.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,图示装置还缺少的一种仪器为酒精灯.装置B中饱和食盐水的作用是除去Cl2中的HCl气体;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d(填字母).
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:2OH-+Cl2=Cl-+ClO-+H2O.
6.为了除去工业微量的Br2中微量的Cl2,可向工业Br2中( )
| A. | 通入HBr | B. | 加入NaCO3溶液 | C. | 加入NaBr | D. | 加入Na2SO3溶液 |
14.下说法正确的是( )
| A. | NaHSO4在熔融的状态下能够导电是因为:NaHSO4═Na++HSO4- | |
| B. | pH=1的无色溶液中能大量共存的离子有:CO32-、Na+、Cl-、Ba2+ | |
| C. | 能用Fe3++3OH-=Fe(OH)3↓表示的化学方程式可以是:2Fe(NO3)3+3Mg(OH)2═2Fe(OH)3↓+3Mg(NO3)2 | |
| D. | 铜片和稀HNO3反应离子方程式为:Cu+4H++NO3-═Cu2++NO↑+2H2O |
15.欲除去表溶液中的杂质,写出所加试剂(适量)的化学式和有关离子方程式:
| 溶液 | 杂质 | 应加试剂 | 离子方程式 |
| BaCl2 | HCl | ||
| Na2SO4 | Na2CO3 | ||
| FeCl2 | CuCl2 |
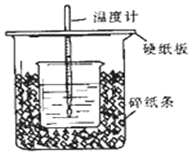 ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.
①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.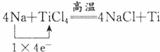 ,氧化剂:TiCl4,还原剂:Na.
,氧化剂:TiCl4,还原剂:Na.