题目内容
19.常温下0.1mol•L-1氨水溶液的pH=a,下列能使溶液pH=(a-1)的措施是( )| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的NH4Cl固体 | ||
| C. | 加入等体积0.2mol•L-1NaOH溶液 | D. | 提高溶液的温度 |
分析 一水合氨是弱电解质,所以氨水中存在电离平衡,要使氨水溶液的pH减小1,但溶液仍然为碱性,则加入的物质能抑制一水合氨的电离,据此解答.
解答 解:A.一水合氨是弱电解质,所以氨水中存在电离平衡,将溶液稀释到原体积的10倍,则促进一水合氨的电离,氨水的浓度大于原来的$\frac{1}{10}$,所以稀释后溶液的pH>(a-1),故A错误;
B.向氨水中加入氯化铵固体,铵根离子浓度增大而抑制一水合氨的电离,氨水中氢氧根离子浓度减小,所以可以使溶液的pH=(a-1),故B正确;
C.加入的0.2mol/L的NaOH溶液中的氢氧根的浓度为0.2mol/L,比0.1mol/L氨水中的氢氧根的浓度更大,故越加氢氧化钠溶液,溶液的碱性越强,即pH越大,不可能变为(a-1),故C错误;
D、一水合氨为弱碱,存在电离平衡,提高温度后电离平衡被促进,则溶液中的氢氧根的浓度会增大,则pH增大,故D错误.
故选B.
点评 本题考查弱电解质的电离,明确“碱无论如何稀释都不能变为酸”,结合一水合氨的电离特点分析解答,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.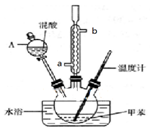 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
反应原理: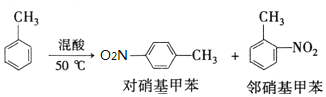
实验中可能用到的数据:
实验步骤:
①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如下:

其中,操作1的名称为分液,操作2必需的玻璃仪器有6种
(5)本实验中一硝基甲苯的产率为77.5%(已知:甲苯的分子量为92,一硝基甲苯的分子量为137,结果保留小数点后一位数字).
 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):反应原理:

实验中可能用到的数据:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如下:

其中,操作1的名称为分液,操作2必需的玻璃仪器有6种
(5)本实验中一硝基甲苯的产率为77.5%(已知:甲苯的分子量为92,一硝基甲苯的分子量为137,结果保留小数点后一位数字).
7.下列一定能说明X的金属性大于Y的是( )
| A. | 金属阳离子的氧化性:Y>X | |
| B. | X、Y用导线连接后插入浓硝酸中,X溶解 | |
| C. | X、Y用导线连接后插人稀盐酸中,Y的表面有气泡产生 | |
| D. | X、Y用导线连接后插入氢氧化钠溶液中,X极为电子流出的一极 |
4.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出了其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的确( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为  | |
| C. | 相同压强下,沸点:C3F8)<C5H8 | |
| D. | 全氟丙烷分子中既有极性键又有非极性键 |
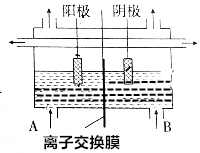 工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.
工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.