题目内容
10.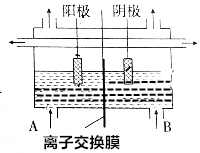 工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.
工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.
分析 电解饱和食盐水生成氯气、氢气和氢氧化钠溶液,氯气与氢气接触容易爆炸,氯气与氢氧化钠反应生成次氯酸钠;阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,和氢氧根离子,钠离子向阴极移动在阴极与氢氧根离子结合生成氢氧化钠,据此分析.
解答 解:电解饱和食盐水生成氯气、氢气和氢氧化钠溶液,将两个电极室用离子交换膜隔开,可以防止氯气与氢气接触发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯;阳极上氯离子失电子生成氯气,所以阳极室加入的是饱和食盐水;阴极上氢离子得电子生成氢气,和氢氧根离子,钠离子向阴极移动在阴极与氢氧根离子结合生成氢氧化钠,所以阴极室加入的是水或稀的氢氧化钠溶液;所以离子交换膜只许Na+离子通过;
故答案为:防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯;饱和食盐水;水或稀氢氧化钠溶液;Na+.
点评 本题考查了电解原理的分析应用,注意把握电极上离子的放电顺序、以及阴阳极上发生的反应,掌握电解原理是解题关键,题目难度不大.

练习册系列答案
相关题目
1.下列反应的△H>0的是( )
| A. | Ba(OH)2?8H2O与NH4Cl的反应 | B. | 碳在氧气中燃烧的反应 | ||
| C. | 酸碱中和反应 | D. | 生石灰和水的反应 |
18.下列离子方程式书写错误的是( )
| A. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| B. | NaAlO2溶液中通入少量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO2-+H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4OH-═AlO2-+H2O |
15.下列离子方程式书写正确的是( )
| A. | 往碳酸钙溶液中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 向次氯酸钙溶液通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| C. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
2.在溶液中能大量共存的一组离子是( )
| A. | Ba2+、Fe3+、Br-、SO42- | B. | Na+、Ca2+、HCO3-、OH- | ||
| C. | Al3+、NH4+、SO42-、Cl- | D. | Na+、H+、NO3-、SO32- |
19.常温下0.1mol•L-1氨水溶液的pH=a,下列能使溶液pH=(a-1)的措施是( )
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的NH4Cl固体 | ||
| C. | 加入等体积0.2mol•L-1NaOH溶液 | D. | 提高溶液的温度 |
20.在室温下,下列各组微粒在溶液中能大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、Cl-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |