题目内容
11.把0.1molMnO2粉末加入50mL过氧化氢的溶液里(密度为1.1g•mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示.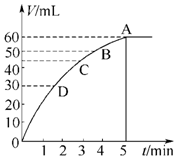
(1)实验时放出气体的体积为60mL.
(2)放出一半气体所需的时间约为2min.
(3)A、B、C、D各点反应速率由快到慢的顺序是D>C>B>A.
(4)根据曲线形状解释反应速率变化的原因随着反应进行双氧水浓度逐渐减小,则反应速率逐渐减小.
(5)计算反应前过氧化氢的物质的量浓度0.11mol/L.
分析 (1)反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)图象中曲线的斜率表示化学反应速率,斜率越大其反应速率越大;
(4)反应物浓度越大反应速率越大,即反应物浓度与反应速率成正比;
(5)根据氧气和过氧化氢之间的关系式计算过氧化氢浓度.
解答 解:(1)反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积为60mL,故答案为:60mL;
(2)反应放出气体体积为气体总体积一半为30mL,根据图知,生成氧气体积为30mL时需要的时间约为2min,
故答案为:2min;
(3)图象中曲线的斜率表示化学反应速率,斜率越大其反应速率越大,根据图知,斜率大小顺序是D>C>B>A,所以反应速率大小顺序是D>C>B>A,故答案为:D>C>B>A;
(4)反应物浓度越大反应速率越大,即反应物浓度与反应速率成正比,随着反应进行,双氧水浓度越来越小,则反应速率越来越小,故答案为:随着反应进行双氧水浓度逐渐减小,则反应速率逐渐减小;
(5)设双氧水物质的量浓度为xmol/L,则n(H2O2)=0.05xmol,根据2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑知,n(H2O2)=2(O2)=2×$\frac{0.06L}{22.4L/mol}$=0.05xmol,x=0.11,
故答案为:0.11mol/L.
点评 本题考查化学反应速率影响因素、化学方程式有关计算等知识点,为高频考点,侧重考查学生分析、判断及计算能力,明确该图象中曲线斜率含义是解本题关键,会利用运用关系式进行计算,题目难度不大.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案| A. | Ba(OH)2?8H2O与NH4Cl的反应 | B. | 碳在氧气中燃烧的反应 | ||
| C. | 酸碱中和反应 | D. | 生石灰和水的反应 |
| A. | Ba2+、Fe3+、Br-、SO42- | B. | Na+、Ca2+、HCO3-、OH- | ||
| C. | Al3+、NH4+、SO42-、Cl- | D. | Na+、H+、NO3-、SO32- |
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的NH4Cl固体 | ||
| C. | 加入等体积0.2mol•L-1NaOH溶液 | D. | 提高溶液的温度 |
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 2.0mol/L | D. | 3.0mol/L |
| A. | CO2→CO | B. | C→CO2 | C. | CuO→Cu | D. | H2SO4→SO2 |
| A. | 氯气通入水中:Cl2+H2O═Cl-+ClO+2H+ | |
| B. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | Fe与盐酸反应制H2:2Fe+6H+═2Fe3++3H2↑ |
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、Cl-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
| W | |||
| Y | Z |
| A. | X能分别与Y、W形成化合物,且其所含化学键类型完全相同 | |
| B. | W有多种同素异形体,且均具有高熔点、高沸点的性质 | |
| C. | X的离子半径一定小于Y同族的短周期元素的离子半径 | |
| D. | Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z |