题目内容
下列有关卤族元素的说法中,正确的是( )
| A、原子半径:F>Cl>Br>I |
| B、单质的氧化性:I2>Br2>Cl2>F2 |
| C、熔、沸点:F2>Cl2>Br2>I2 |
| D、热稳定性:HF>HCl>HBr>HI |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题
分析:A.卤族元素中,原子半径随着原子序数的增大而增大;
B.卤族单质的氧化性随着原子序数的增大而减弱;
C.卤素单质的熔沸点随着原子序数的增大而增大;
D.元素的非金属性越强,其氢化物越稳定.
B.卤族单质的氧化性随着原子序数的增大而减弱;
C.卤素单质的熔沸点随着原子序数的增大而增大;
D.元素的非金属性越强,其氢化物越稳定.
解答:
解:A.卤族元素中,原子核对核外电子的吸引力随着原子电子层数的增大而减弱,所以原子半径随着原子序数的增大而增大,故A错误;
B.元素的非金属性越强其单质的氧化性越强,卤素元素的非金属性随着原子序数的增大而减弱,所以卤族单质的氧化性随着原子序数的增大而减弱,故B错误;
C.卤素单质结构相似且都是分子晶体,其单质的熔沸点与其相对分子质量成正比,所以卤素单质的熔沸点随着原子序数的增大而增大,故C错误;
D.元素的非金属性越强,其氢化物越稳定,卤族元素非金属性F>Cl>Br>I,所以热稳定性:HF>HCl>HBr>HI,故D正确;
故选D.
B.元素的非金属性越强其单质的氧化性越强,卤素元素的非金属性随着原子序数的增大而减弱,所以卤族单质的氧化性随着原子序数的增大而减弱,故B错误;
C.卤素单质结构相似且都是分子晶体,其单质的熔沸点与其相对分子质量成正比,所以卤素单质的熔沸点随着原子序数的增大而增大,故C错误;
D.元素的非金属性越强,其氢化物越稳定,卤族元素非金属性F>Cl>Br>I,所以热稳定性:HF>HCl>HBr>HI,故D正确;
故选D.
点评:本题考查了同一主族元素性质的变化规律,熟记同一主族金属、非金属有关的元素周期律是解本题关键,根据元素周期律来分析解答,知道其变化原因,题目难度不大.

练习册系列答案
相关题目
NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )


| A、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B、石灰乳和Cl2反应可制得漂白粉,其主要成分是次氯酸钙 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、如图所示转化反应不都是氧化还原反应 |
磷酸钙陶瓷也是一种新型无机非金属材料,它可以用于制成人造骨骼,这是利用这类材料的( )
| A、耐高温特性 | B、电学特性 |
| C、光学特性 | D、生物功能 |
短周期元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A、吸引电子能力的大小顺序一定为Z>Y>W |
| B、原子半径的大小顺序一定为X>Y>Z>W |
| C、Y、Z形成的分子的空间构型一定是正四面体 |
| D、原子核外未成对电子数可能是Z>Y>X>W |
下列离子方程式的书写符合前提所述的情况的是( )
| A、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-→NH3↑+H2O |
| B、在NH4Al(SO4)2(一种复盐)的溶液中加入Ba(OH)2溶液至沉淀的质量达到最大时:Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| C、当Ba(OH)2和NaHSO4 混合恰好呈中性:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O |
| D、向烧碱溶液中通入CO2,当n(NaOH):n(CO2)=3:2时:OH-+CO2→HCO3- |
水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-→Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
| A、每生成1mol Fe3O4,反应转移的电子总数为2mol | ||
| B、Fe2+和S2O32-都是还原剂 | ||
C、1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
| ||
| D、x=4 |
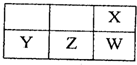 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )| A、X、Z、W的简单氢化物的稳定性Z>W>X |
| B、W元素的单质在化学反应中只表现还原性 |
| C、X、Y的简单离子半径Y>X |
| D、Y、Z、W的最高价氧化物均能与NaOH溶液反应 |
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )


| A、发生电化学腐蚀,铜为负极,铜极产生H2 |
| B、铜易被腐蚀,铜极上发生还原反应,吸收O2 |
| C、铁易被腐蚀,铁发生氧化反应,Fe-2e→Fe2+ |
| D、发生化学腐蚀:Fe+Cu2+→Cu+Fe2+ |



