题目内容
NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )
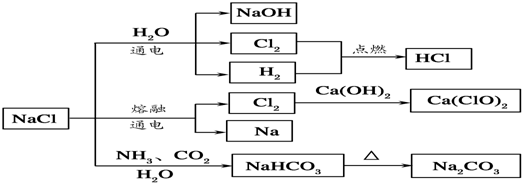

| A、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B、石灰乳和Cl2反应可制得漂白粉,其主要成分是次氯酸钙 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、如图所示转化反应不都是氧化还原反应 |
考点:氯、溴、碘及其化合物的综合应用
专题:元素及其化合物
分析:A、根据其阴离子的水解程度判断;
B、根据漂白粉的成分和有效成分的区别来回答;
C、铁能在氯气中燃烧生成棕黄色的烟FeCl3;
D、根据元素的化合价是否变化判断.
B、根据漂白粉的成分和有效成分的区别来回答;
C、铁能在氯气中燃烧生成棕黄色的烟FeCl3;
D、根据元素的化合价是否变化判断.
解答:
解:A、碳酸根的第一步水解(水解后生成碳酸氢根和氢氧根)的平衡常数比碳酸氢根要大许多.碳酸根水解要比碳酸氢根容易得多.所以溶解度较大,且溶解的快,故A错误;
B、2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,漂白粉主要成分是次氯酸钙和氯化钙的混合物,故B错误;
C、3Cl2+2Fe
2FeCl3,故C错误;
D、氯化钠和水、氨气、二氧化碳的反应以及碳酸氢钠的分解反应都不是氧化还原反应,故D正确.
故选D.
B、2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,漂白粉主要成分是次氯酸钙和氯化钙的混合物,故B错误;
C、3Cl2+2Fe
| ||
D、氯化钠和水、氨气、二氧化碳的反应以及碳酸氢钠的分解反应都不是氧化还原反应,故D正确.
故选D.
点评:本题涉及元素以及化合物性质的考查,注意漂白粉主要成分是次氯酸钙,成分是次氯酸钙和氯化钙的混合物,这一知识点是易错点,难度不大.

练习册系列答案
相关题目
化学式为C5H10O2的物质中,能与Na2CO3反应的放出气体的物质的结构共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
硫酸的铵盐是常用的氮肥.为测定某硫酸铵盐的含氮量(不含其他物质),取样品加入到氢氧化钠溶液中,用沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸完全吸收,测定浓硫酸增加的质量.下表是五次实验的数据:
以下结论正确的是( )
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 铵盐样品质量(g) | 5.00 | 10.00 | 20.00 | 30.00 | 40.00 |
| 同浓度氢氧化钠溶液的体积(mL) | 40 | 40 | 40 | 40 | 40 |
| 浓硫酸增加的质量(g) | 0.5m | m | m | 1.36 | 0 |
| A、由第五次数据可知,样品中含NH4HSO4 |
| B、第四次实验中,产生的氨气是0.06mol |
| C、第三次和第四次实验中参加反应的NaOH质量不等 |
| D、该铵盐中该氮元素的质量分数约是0.17 |
在周期表中,第2、4、6周期元素的数目分别是( )
| A、8、8、18 |
| B、8、18、18 |
| C、8、8、32 |
| D、8、18、32 |
下列各组微粒具有相同的质子数和电子数的是( )
| A、OH-、H2O、F- | ||||
B、NH3、NH
| ||||
| C、HCl、F2、H2S | ||||
D、H3O+、NH
|
X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素.下列说法正确的是( )
| A、五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B、X、Z两元素能形成原子个数比(X:Z)为3:1和4:2的化合物 |
| C、化合物YW2、ZW2都是酸性氧化物 |
| D、用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
元素周期表中铋元素的数据见图,下列说法不正确的是( )


| A、Bi元素的质量数是209 |
| B、Bi元素的相对原子质量是209.0 |
| C、Bi元素属于金属元素 |
| D、Bi原子核外有83个电子 |
下列有关卤族元素的说法中,正确的是( )
| A、原子半径:F>Cl>Br>I |
| B、单质的氧化性:I2>Br2>Cl2>F2 |
| C、熔、沸点:F2>Cl2>Br2>I2 |
| D、热稳定性:HF>HCl>HBr>HI |
 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.