题目内容
3.25℃时,0.1mol•L-1的CH3COONa溶液的pH=a,下列说法正确的是( )| A. | 该溶液的中水电离出的c(H+)=10-amol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(Cl-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 25℃时,0.1mol•L-1的CH3COONa溶液的pH=a,该溶液中c(H+)=10-amol/L,氢氧根离子浓度为:c(OH-)=10a-14mol/L,
A.醋酸钠溶液中,醋酸根离子数据促进了水的电离,其溶液的氢氧根离子是水的电离的;
B.稀释后溶液中氢氧根离子浓度减小,则水的电离程度减小;
C.溶液的pH=7,则c(H+)=c(OH-),结合物料守恒和电荷守恒分析;
D.若加入的醋酸过量,可能满足c(H+)>c(Na+).
解答 解:25℃时,0.1mol•L-1的CH3COONa溶液的pH=a,该溶液中c(H+)=10-amol/L,氢氧根离子浓度为:c(OH-)=10a-14mol/L,
A.CH3COONa溶液中,醋酸根离子发生水解,促进了水的电离,其溶液中的氢氧根离子是水电离大量,则该溶液的中水电离出的c(H+)=c(OH-)=10a-14mol/L,故A错误;
B.醋酸钠溶液中的氢氧根离子是水电离的,稀释后醋酸钠溶液中氢氧根离子浓度减小,则水的电离程度减小,故B错误;
C.加入盐酸,pH=7时c(H+)=c(OH-),根据电荷守恒c(CH3COO-)+c(Cl-)+c(OH-)=c(Na+)+c(H+)可知:c(CH3COO-)+c(Cl-)=c(Na+),结合物料守恒c(CH3COO-)+c(CH3COOH)=c(Na+)可知,c(Cl-)=c(CH3COOH),故C正确;
D.向溶液中加入醋酸呈酸性,可能会出现c(H+)>c(Na+),此时离子浓度大小为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、水的电离及其影响为解答结构,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO32- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | NO3-、K+、CO32-、OH- |
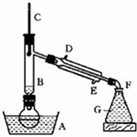 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr$\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是:检查装置的气密性,实验进行的途中若发现未加入碎瓷片,其处理的方法是待冷却后重新进行操作.
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃之间.
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是SO2+2OH-=SO32-+H2O,Br2+2OH-=Br-+BrO-+H2O,此操作可在分液漏斗(填写玻璃仪器名称)中进行,同时进行分离.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了防止溴化氢气体的挥发.
(5)粗产品中含有的主要有机液体杂质是乙醚,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行蒸馏操作.
| A. | 由X、Z、M三种元素组成的化合物一定是共价化合物 | |
| B. | Q与M形成的化合物可以作为光导纤维的主要原料,且不与任何酸反应 | |
| C. | 元素的非金属性由强到弱的顺序:M>Z>Q>Y | |
| D. | 原子半径由大到小的顺序:N>Q>Z>M |
| A. | NO3-、BF3、N2O | B. | SO3、CO2、NO2 | C. | CO、N2、CN- | D. | CO2、SCN-、NO2+ |
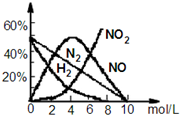 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: