题目内容
9.下列粒子属于等电子体而且粒子的空间构型相同的一组是( )| A. | NO3-、BF3、N2O | B. | SO3、CO2、NO2 | C. | CO、N2、CN- | D. | CO2、SCN-、NO2+ |
分析 具有相同原子数和价电子数的微粒之间互称等电子体,等电子体往往具有相似的空间构型,抓住等电子体的特点进行分析、判断,即可解答.
解答 解:A.NO3-、BF3、N2O原子个数分别为4、4、3,不属于等电子体,故A错误;
B.SO3、CO2、NO2原子个数分别为4、3、3,不属于等电子体,故B错误;
C.CO、N2、CN-原子个数都为2;价电子数:前者碳为4,氧为6,共为10,中间氮为5,2个氮共为10,后者碳为4,氮为5,带一单位负电荷,共为10,原子数和价电子数都相等,属于等电子体,CO、N2、CN-空间构型都为直线型,故C正确;
D.CO2、SCN-、NO2+原子个数都为3;价电子数:前者碳为4,氧为6,共为16,中间硫为6、碳为4、氮为5,带一单位负电荷,共为16,后者氮为5,氧为6,带一单位正电荷,共为16,原子数和价电子数都相等,属于等电子体,CO2、SCN-、NO2+空间构型都为直线型,故D正确;
故选CD.
点评 本题考查了等电子体,解答本题关键是充分理解等电子体的本质特征,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
2.某有机物的分子式为C5H11Cl,该有机物的同分异构体共有(不考虑立体异构)几种( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
3.25℃时,0.1mol•L-1的CH3COONa溶液的pH=a,下列说法正确的是( )
| A. | 该溶液的中水电离出的c(H+)=10-amol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(Cl-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
17.下列关于离子的检验正确的是( )
| A. | 向某溶液中加入足量稀硫酸,无明显现象,再加入AgNO3溶液,出现白色沉淀,则溶液中有Cl- | |
| B. | 向某溶液中滴加浓硫酸,将产生的气体通入品红溶液中,品红褪色,则溶液中一定有SO32- | |
| C. | 用洁净的铂丝蘸取某溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰呈紫色,则溶液中有K+ | |
| D. | 在某溶液中,先加入足量BaCl2溶液,有白色沉淀生成;再加入足量稀盐酸,沉淀不溶解,则证明该溶液中含SO42- |
4.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①反应的速率时间罔像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是BC(填对应字母).
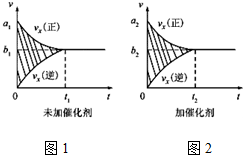
A.a1>a2,B.b1<b2 C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
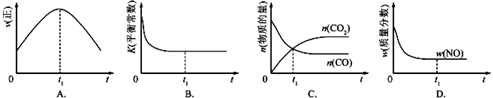
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号)
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
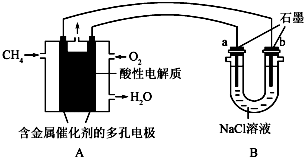
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①反应的速率时间罔像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是BC(填对应字母).

A.a1>a2,B.b1<b2 C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
14. 某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
 某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
18.大枣等红色食物因富含铁,是很好的补铁食品.但因其中铁为Fe3+很难被人体直接吸收,需要食用富含维生素C的食物,将其转化为Fe2+,维生素C所具有的性质是( )
| A. | 氧化性 | B. | 还原性 | C. | 酸性 | D. | 碱性 |
19.将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品.

已知:合成甲醇的主反应为:CO+2H2?CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2?C8H18+8H2O+Q
4CO+8H2?C4H9OH+3H2O+Q.
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是BaSO4、CaCO3、BaCO3、Mg(OH)2(填写化学式).
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2TiCl4+2FeCl3+6CO.
(3)诸如上述联合生产,其优点有大大提高资源利用率;降低生产成本;减少环境污染等.生产中除了获得上述目标产品外,还能得到副产品C8H18、C4H9OH、FeCl3、MgCl2(填写化学式).
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H210吨(不考虑生产过程中物质的损失及副反应).
(5)上述产业链中“氯化”在600℃以上的反应器内进行.已知:
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分.

已知:合成甲醇的主反应为:CO+2H2?CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2?C8H18+8H2O+Q
4CO+8H2?C4H9OH+3H2O+Q.
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是BaSO4、CaCO3、BaCO3、Mg(OH)2(填写化学式).
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2TiCl4+2FeCl3+6CO.
(3)诸如上述联合生产,其优点有大大提高资源利用率;降低生产成本;减少环境污染等.生产中除了获得上述目标产品外,还能得到副产品C8H18、C4H9OH、FeCl3、MgCl2(填写化学式).
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H210吨(不考虑生产过程中物质的损失及副反应).
(5)上述产业链中“氯化”在600℃以上的反应器内进行.已知:
| 物质 | 沸点(℃) |
| TiCl4 | 136 |
| FeCl3 | 315 |