题目内容
14.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如图1,请回答下列问题: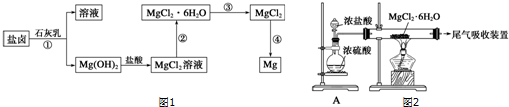
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是石灰乳原料丰富,成本低.
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有MgCl2溶液的烧杯中,充分搅拌后经过滤、洗涤(填操作方法)可得纯净的Mg(OH)2.
(3)写出过程④中发生反应的化学方程式MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(4)图2是该兴趣小组设计进行过程③的实验装置图,其中装置A的作用是制备干燥的HCl气体.
将浓盐酸滴入浓硫酸而不是将浓硫酸滴入浓盐酸的理由是得到的HCl气体不带有水蒸气.利用该装置加热MgCl2•6H2O能得到无水MgCl2的原因是干燥的HCl气体抑制MgCl2•6H2O水解,并带走水蒸气.
分析 向海水中加入沉淀剂石灰乳,镁离子转化为Mg(OH)2,采用过滤的方法分离溶液和Mg(OH)2,Mg(OH)2将溶于稀盐酸得到MgCl2溶液,将MgCl2溶液在HCl氛围中蒸干得到MgCl2固体,电解熔融MgCl2固体得Mg.
(1)从生产成本考虑;
(2)从沉淀转化的角度分析;
(3)电解法冶炼Mg;
(4)在HCl气流中可抑制氯化镁水解.
解答 解:向海水中加入沉淀剂石灰乳,镁离子转化为Mg(OH)2,采用过滤的方法分离溶液和Mg(OH)2,Mg(OH)2将溶于稀盐酸得到MgCl2溶液,将MgCl2溶液在HCl氛围中蒸干得到MgCl2固体,电解熔融MgCl2固体得Mg.
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是石灰乳原料丰富,成本低,
故答案为:石灰乳原料丰富,成本低;
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有MgCl2溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2,
故答案为:MgCl2;过滤;洗涤;
(3)过程④中发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(4)图2是该兴趣小组设计进行过程③的实验装置图,其中装置A的作用是制备干燥的HCl气体.浓盐酸滴入浓硫酸而不是将浓硫酸滴入浓盐酸的理由是得到的HCl气体不带有水蒸气.利用该装置加热MgCl2•6H2O能得到无水MgCl2的原因是干燥的HCl气体抑制MgCl2•6H2O水解,并带走水蒸气,
故答案为:制备干燥的HCl气体;得到的HCl气体不带有水蒸气;干燥的HCl气体抑制MgCl2•6H2O水解,并带走水蒸气.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 乙炔分子的球棍模型: | B. | 羟基的电子式: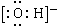 | ||
| C. | 2氯丙烷的结构简式:CH3CHClCH3 | D. | 丙烯的键线式: |
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
 ,该原子( )
,该原子( )| A. | 核电荷数为32 | B. | 核外电子数为16 | C. | 最外层电子数为6 | D. | 核外电子层数为3 |
| A. | 该溶液的中水电离出的c(H+)=10-amol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(Cl-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |

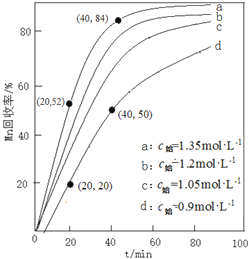
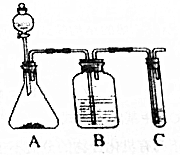 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.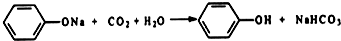 ;
;