��Ŀ����
12������Ԫ��X��Y��Z��M��N��Q��ԭ���������������Ҳ�����18������X��Nͬ���壬Y��Qͬ���壬N��Qͬ���ڣ���֪�����µ���X��N��״̬��ͬ��M�ĺ˵������Y��������������2��������Q��һ����Ҫ�İ뵼����ϣ������ƶ�����ȷ���ǣ�������| A�� | ��X��Z��M����Ԫ����ɵĻ�����һ���ǹ��ۻ����� | |
| B�� | Q��M�γɵĻ����������Ϊ���ά����Ҫԭ�ϣ��Ҳ����κ��ᷴӦ | |
| C�� | Ԫ�صķǽ�������ǿ������˳��M��Z��Q��Y | |
| D�� | ԭ�Ӱ뾶�ɴ�С��˳��N��Q��Z��M |
���� ����Ԫ��X��Y��Z��M��N��Q��ԭ���������������Ҳ�����18������Q��һ����Ҫ�İ뵼����ϣ���QΪSiԪ�أ�Y��Qͬ���壬����YΪCԪ�أ�X��Nͬ���壬��֪�����µ���X��N��״̬��ͬ�����ԭ��������֪��XӦΪHԪ�أ�NΪNaԪ�أ�M�ĺ˵������Y��������������2������M�ĺ˵����Ϊ2��4=8��ΪOԪ�أ���ZӦΪNԪ�أ����Ԫ�������ɵĵݱ���ɽ����⣮
��� �⣺����Ԫ��X��Y��Z��M��N��Q��ԭ���������������Ҳ�����18������Q��һ����Ҫ�İ뵼����ϣ���QΪSiԪ�أ�Y��Qͬ���壬����YΪCԪ�أ�X��Nͬ���壬��֪�����µ���X��N��״̬��ͬ�����ԭ��������֪��XӦΪHԪ�أ�NΪNaԪ�أ�M�ĺ˵������Y��������������2������M�ĺ˵����Ϊ2��4=8��ΪOԪ�أ���ZӦΪNԪ�أ�
A��XΪH��ZΪN��MΪO������Ԫ����ɵĻ������ΪNH4NO3��Ϊ���ӻ������A����
B��Q��M�γɵĻ�����������������Ϊ���ά����Ҫԭ�ϣ���������������ᷴӦ����B����
C��Ԫ�صķǽ�������ǿ������˳����O��N��C��Si����M��Z��Y��Q����C����
D��ԭ�Ӱ뾶Na��Si��N��O��N��O�ڵڶ����ڣ�Na��Si�ڵ������ڣ���ԭ�Ӱ뾶Na��Si��N��O����N��Q��Z��M����D��ȷ��
��ѡD��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɵĹ�ϵ����Ŀ�Ѷ��еȣ�����ע��������ʵ�ͨ;�Լ���ӦԪ�ص�ԭ�ӽṹ�ƶ�Ԫ�ص����࣬ѧϰ��ע�����Ԫ�������ɵĵݱ���ɣ�

| A�� | ����Һ����ˮ�������c��H+��=10-amol/L | |
| B�� | ��ˮϡ�ͣ������Ƶ�ˮ��̶�����ˮ�ĵ���̶�Ҳ���� | |
| C�� | �������ᣬpH=7ʱ����c��Cl-��=c��CH3COOH�� | |
| D�� | ����Һ�м����������ԣ���һ����c��CH3COO-����c��Na+����c��H+����c��OH-�� |
| A�� | C2H6O | B�� | CH3O | C�� | C4H12O2 | D�� | C5H10O4 |
| A�� | ��ij��Һ�м�������ϡ���ᣬ�����������ټ���AgNO3��Һ�����ְ�ɫ����������Һ����Cl- | |
| B�� | ��ij��Һ�еμ�Ũ���ᣬ������������ͨ��Ʒ����Һ�У�Ʒ����ɫ������Һ��һ����SO32- | |
| C�� | �ýྻ�IJ�˿պȡij��Һ����ɫ���������գ�����ɫ�ܲ����۲�������ɫ������Һ����K+ | |
| D�� | ��ij��Һ�У��ȼ�������BaCl2��Һ���а�ɫ�������ɣ��ټ�������ϡ���ᣬ�������ܽ⣬��֤������Һ�к�SO42- |
��1������β����������Ҫԭ��Ϊ��2NO��g��+2CO$?_{����}^{����}$2CO2��g��+N2��g����H��O
�ٷ�Ӧ������ʱ��������ͼ1��ʾ���������������䣬���ڷ�Ӧǰ������ʵĴ�����������ʱ��ͼ����ͼ2��ʾ������˵����ȷ����BC�����Ӧ��ĸ����
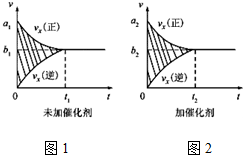
A��a1��a2��B��b1��b2 C��t1��t2
D��ͼ2����Ӱ�����������
E��ͼ1����Ӱ�����������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����BD������ţ�
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4��g��+2NO2��g��?N2��g��+CO2��g��+2H2O��g����H=-867kJ/mol
2NO2��g��?N2O4��g����H=-56.9kJ/mol H2O��g��=H2O��l����H=-44.0kJ/mol
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ��CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=-898.1kJ/mol��
��3��CH4��H2O��g�� �ڴ������淢����ӦCH4+H2O?CO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�������
| �¶�/�� | 800 | 1000 | 1200 | 1400 |
| ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
��T��ʱ����1L�ܱ�������Ͷ��l mol CH4��l mol H2O��g����ƽ��ʱc��CH4��=0.5mol/L�����¶��·�ӦCH4+H2O?CO+3H2��ƽ�ⳣ��K=6.75��
��4������ȼ�ϵ�ؿ����������������ʣ���ͼ�����ü���ȼ�ϵ�ص��100ml1mol/Lʳ��ˮ�����һ��ʱ����ռ�����״���µ�����2.24L���������Һ������䣩��
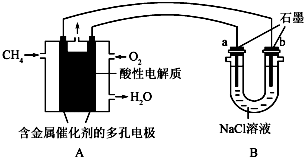
�ټ���ȼ�ϵ�صĸ�����Ӧʽ��CH4-8e-+2H2O=CO2+8H+
�ڵ�����Һ��pH=14����������������������Һ��Ӧ��
�������������������ڱ�״������1.68L��
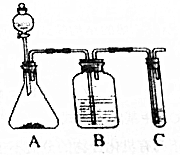 ������ͼװ�û�������֤���ᡢ���ӡ�̼�������ǿ����
������ͼװ�û�������֤���ᡢ���ӡ�̼�������ǿ����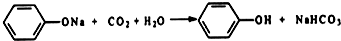 ��
��