题目内容
15.下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
| A. | X元素是电负性最大的元素 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | W元素的第一电离能小于Y元素的第一电离能 |
分析 由元素在周期表的位置可知,X、Y、Z、W、R分别是F、S、Br、P、Ar元素,
A.元素的非金属性越强,则元素的电负性越强;
B.元素的简单阴离子电子数与其同周期0族元素相等;
C.p能级未成对电子数最多的是第VA族元素;
D.P的3p电子半满为稳定结构.
解答 解:由元素在周期表的位置可知,X、Y、Z、W、R分别是F、S、Br、P、Ar元素,
A.元素的非金属性越强,则元素的电负性越强,则X元素是电负性最大的元素,故A正确;
B.元素的简单阴离子电子数与其同周期0族元素相等,则Y的阴离子电子层结构都与R原子的相同,Z的比R的电子层多1,故B错误;
C.p能级未成对电子数最多的是第VA族元素,即p能级未成对电子最多的是W元素,故C错误;
D.P的3p电子半满为稳定结构,则W元素的第一电离能大于Y元素的第一电离能,故D错误;
故选A.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意电负性、电离能的判断,题目难度不大.

练习册系列答案
相关题目
6.下列所述事实与化学(或离子)方程式不相符的是( )
| A. | 能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | 能说明盐酸是强酸:HCl+AgNO3=AgCl↓+HNO3 | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
10.对于氨水的组成的叙述正确的是( )
| A. | 只含有氨分子和水分子 | |
| B. | 只含有一水合氨分子和水分子 | |
| C. | 只含有氨分子、水分子和一水合氨分子 | |
| D. | 含有氨分子、水分子、一水合氨分子、铵根离子、氢离子和氢氧根离子 |
20.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法中,正确的是( )
| A. | H2SO4的摩尔质量是98g | |
| B. | 1molO2的质量是32g | |
| C. | 铁的摩尔质量等于铁原子的相对原子质量 | |
| D. | 1molNa+的质量是23g/mol |
5.如表是50mL稀盐酸和1g碳酸钙反应的实验数据:
分析上述数据,回答下列问题:
(1)本反应属于放热反应(填吸热或放热),实验中的所有反应,反应前后溶液的温度变化值相近(约为20℃),推测其原因是反应掉碳酸钙的量相同,放出的热量相同.
(2)实验6和7表明,温度对反应速率有影响,温度越高反应速率
越快,能表明同一规律的实验还有8和9(填实验序号).
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是其它条件一定,反应物浓度越大,反应速率越快.
(4)本实验中影响反应速率的其它因素还有反应物的接触面积,能表明这一规律的实验序号是1、2与4和5.
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
(1)本反应属于放热反应(填吸热或放热),实验中的所有反应,反应前后溶液的温度变化值相近(约为20℃),推测其原因是反应掉碳酸钙的量相同,放出的热量相同.
(2)实验6和7表明,温度对反应速率有影响,温度越高反应速率
越快,能表明同一规律的实验还有8和9(填实验序号).
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是其它条件一定,反应物浓度越大,反应速率越快.
(4)本实验中影响反应速率的其它因素还有反应物的接触面积,能表明这一规律的实验序号是1、2与4和5.
6.双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )
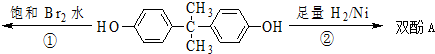

| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗4mol Br2 | |
| D. | 反应②的产物中有两种官能团 |
 .
.