题目内容
6.下列有关性质的递变关系,正确的是( )| A. | 离子半径:Na+<S2-<Cl-<K+ | B. | 还原性:I-<Br-<-Cl<F- | ||
| C. | 稳定性:SiH4<PH3<HCl<HBr | D. | 溶解性:BaO4<CaSO4<MgSO4. |
分析 A、核外电子排布相同的离子,核电核数越大半径越小;
B、同一主族的元素,从上而下,元素的非金属性逐渐减弱,对应的阴离子的还原性越强;
C、元素的非金属性越强,则气态氢化物的稳定性越强;
D、第二主族的元素,从上到下,对应的硫酸盐的溶解度逐渐降低.
解答 解:A、粒子的电子层数越多,半径越大,故Na+的半径最小;当电子层数相同时,核电荷数越大,则半径越小,故S2->Cl->K+,故大小顺序是S2->Cl->K+>Na+,故A错误;
B、同一主族的元素,从上而下,元素的非金属性逐渐减弱,对应的阴离子的还原性越强,F、Cl、Br、I为第VIIA族的元素,故对应的阴离子的还原性为I->Br->Cl->F-,故B错误;
C、元素的非金属性越强,则气态氢化物的稳定性越强,由于非金属性Cl>Br>P>Si,故氢化物的稳定性为HCl>HBr>PH3>SiH4,故C错误;
D、第二主族的元素,从上到下,对应的硫酸盐的溶解度逐渐降低,即溶解性BaSO4<CaSO4<MgSO4,故D正确.
故选D.
点评 本题考查了元素周期表中元素性质的相似性和递变性,难度不大,掌握元素周期律是解题的关键.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
17.硫黄制酸在我国的工业发展进程中具有重要地位,其工业流程示意图如下.已知硫磺的燃烧热△H=-297kJ•mol-1.下列说法正确的是( )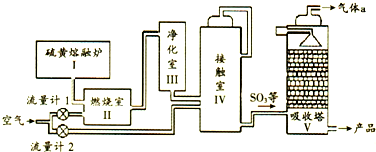

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)?SO3(g)△H=-297kJ•mol-1S(s)+O2(s)=SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2(s) $?_{△}^{催化剂}$SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
14.下列各组化合物中,有关化学键类型的叙述正确的是( )
| A. | CaCl2中既含有离子键又含有共价键 | |
| B. | Na0H中既含有离子键又含有共价键 | |
| C. | Na2O2中只含有离子键 | |
| D. | 由非金属元素组成的物质NH4Cl中只有共价键 |
1.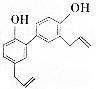 中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
下列有关该物质的叙述正确的是( )
 中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.下列有关该物质的叙述正确的是( )
| A. | 1个厚朴酚分子中含有16个碳原子 | |
| B. | 厚朴酚能使酸性KMnO4溶液褪色,遇FeCl3溶液显色 | |
| C. | 1mol厚朴酚与足量NaHCO3溶液反应放出22.4LCO2(标准状况) | |
| D. | 1mol厚朴酚能与4molBr2(Br2的CCl4溶液)反应 |
11.下列叙述正确的是( )
| A. | 苯中少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却后溶液仍澄清透明 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以与NaCHO3反应放出CO2 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
2.下列粒子中核外电子数相同的是( )
①Al3+ ②○2- ③Cl- ④F-.
①Al3+ ②○2- ③Cl- ④F-.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
19.下表列出了A~R九种元素在周期表的位置:
(1)写出EF2分子的电子式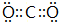 .
.
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)H、I、G三种元素的最高价氧化物对应的水化物中酸性由大到小的顺序排列为Cl>S>Si.(只填写元素符号)
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)H在元素周期表中位置第3周期第IVA族:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
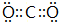 .
.(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)H、I、G三种元素的最高价氧化物对应的水化物中酸性由大到小的顺序排列为Cl>S>Si.(只填写元素符号)
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)H在元素周期表中位置第3周期第IVA族:
20.下列对离子方程式的评价不正确的是( )
| 离子方程式 | 评价 |
| A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液: H3PO3+3OH-=PO33-+3H2O | 正确 |
| B.在亚硫酸中加入少量的次氯酸钠溶液 H2SO3+ClO-=Cl-+2H++SO42- | 正确 |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++2HCO3-+2OH-=Mg CO3↓+CO32-+2H2O | 错误:生成物应是 Mg(OH)2和Na2CO3 |
| D.在过氧化钠中加入稀硫酸: 2Na2O2+4H+=4Na++2H2O+O2↑ | 正确 |
| A. | A | B. | B | C. | C | D. | D |