题目内容
18.下列说法正确的是( )| A. | 1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为2 mol/L | |
| C. | 配制480 mL 0.5 mol/L的CuSO4溶液,需称取62.5 g胆矾 | |
| D. | 中和100 mL 1mol/L的H2SO4溶液,需NaOH为4 g |
分析 A.所得溶液体积不是1L,则溶液浓度不是1mol/L;
B.2mol/L硫酸溶液中氢离子浓度为4mol/L,氢离子浓度与溶液体积大小无关;
C.配制480mLL 0.5mol/L硫酸铜溶液,实际上配制的是500mL 0.5mol/L的硫酸铜溶液,根据n=cV计算出硫酸铜的物质的量,再根据m=nM计算出需要硫酸铜的质量;
D.根据n=cV计算出硫酸的物质的量,然后根据中和反应实质计算出需要氢氧化钠的物质的量及质量.
解答 解:A.58.5gNaCl的物质的量为1mol,由于溶液体积不是1L,则溶液浓度不是1mol/L,故A错误;
B.2 mol/L的H2SO4溶液中氢离子浓度为4mol/L,溶液具有均一性,取出的0.5 L溶液中氢离子的浓度为4mol/L,故B错误;
C.配制480 mL 0.5 mol/L的CuSO4溶液,实际上配制的是500mL 0.5mol/L硫酸铜溶液,需要硫酸铜的物质的量为:0.5mol/L×0.5L=0.25mol,需要胆矾的质量为:250g/mol×0.25mol=6.25g,故C正确;
D.100 mL 1mol/L的H2SO4溶液中含有硫酸的物质的量为:1mol/L×0.1L=0.1L,含有氢离子的物质的量为0.2mol,则需要氢氧化钠的物质的量为0.2mol,需要氢氧化钠的质量为:40g/mol×0.2mol=8g,故D错误;
故选C.
点评 本题考查了物质的量浓度的相关计算,题目难度不大,明确物质的量浓度与物质的量、摩尔质量之间的关系为解答关键,试题得知基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
8.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )
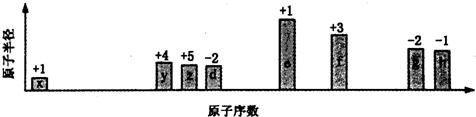

| A. | 离子半径的大小顺序:e>f>g>h | |
| B. | 与x形成简单化合物的沸点:y>z>d | |
| C. | x、z、d三种元素形成的化合物可能含有离子键 | |
| D. | e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应 |
9.下列物质含有离子键但不含共价键的是( )
| A. | C12 | B. | CaCl2 | C. | NH4Cl | D. | HCl |
6.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3.H2S CO2 | B. | H2O NH3•H2O HClO. | ||
| C. | H2SO3.Ba(OH)2BaSO4 | D. | Cu(OH)2CH3COOH CH3COONa |
10.已知Pb 的原子序数为82,再发现与Pb 同一主族的元素R,它的原子序数应为( )
| A. | 90 | B. | 100 | C. | 114 | D. | 132 |
7.在36g碳不完全燃烧所得气体中,CO占$\frac{1}{3}$体积,CO2占$\frac{2}{3}$体积.且有:
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
与这些碳完全燃烧相比,损失的热量是( )
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
与这些碳完全燃烧相比,损失的热量是( )
| A. | 172.5 kJ | B. | 1 149 kJ | C. | 283 kJ | D. | 517.5 kJ |
8.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应为吸热反应(填“吸热”、“放热”),写出该反应的平衡常数表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是bc.
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b,CO2的物质的量为c.
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定.
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”、“放热”),写出该反应的平衡常数表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是bc.
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b,CO2的物质的量为c.
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定.
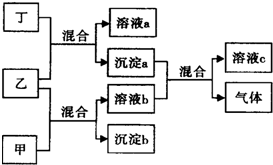 现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):
现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):