题目内容
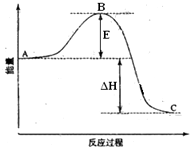 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题:(1)图中A、C分别表示
(2)图中△H=
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5.写出该催化循环机理的化学方程式:
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)根据题干中的信息,V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化,结合化学方程式的原子守恒书写.
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)根据题干中的信息,V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化,结合化学方程式的原子守恒书写.
解答:
解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,
故答案为:反应物总能量;生成物总能量;无;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(3))V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.该催化循环机理的化学方程式为:SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5;
故答案为:SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5.
故答案为:反应物总能量;生成物总能量;无;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(3))V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.该催化循环机理的化学方程式为:SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5;
故答案为:SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5.
点评:本题考查了反应能量的变化关系分析判断,催化剂对反应的影响和实质,热化学方程式的书写原则,题目难度中等.难度不大,注意活化能与反应热的关系.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
下列离子检验的方法正确的是( )
| A、某待测液加入AgNO3溶液,生成白色沉淀,说明原溶液中有Cl- |
| B、某待测液加入BaCl2溶液,生成白色沉淀,说明原溶液中有SO42- |
| C、某待测液加入CaCl2溶液,生成白色沉淀,说明原溶液中有CO32- |
| D、某待测液加入NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ |
汽车燃油不完全燃烧时产生CO2有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H>0,小明学完“化学反应的方向”后,认为该反应不可能实现,最合理的解释是( )
| A、该反应是熵减小反应 |
| B、该反应是吸热反应 |
| C、该反应需要和高的温度 |
| D、该反应是熵减小,烙增加的反应 |
下列事实不能用勒夏特列原理解释的是( )
| A、打开汽水瓶有气泡从溶液中冒出 |
| B、实验室用排饱和食盐水法收集氯气 |
| C、合成氨工厂采用增大压强以提高原料的转化率 |
| D、2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深 |
用价层电子对互斥模型预测下列粒子的立体结构是三角锥形的是( )
| A、PCl3 |
| B、BeCl2 |
| C、NH4+ |
| D、SO2 |
价电子排布为5s25p1的元素,在周期表中的位置是( )
| A、第四周期第ⅤA族 |
| B、第五周期第ⅢA族 |
| C、第五周期第ⅠA族 |
| D、第四周期第ⅢA族 |
下列可证明甲烷分子是正四面体结构的是( )
| A、一氯甲烷没有同分异构体 |
| B、二氯甲烷没有同分异构体 |
| C、三氯甲烷没有同分异构体 |
| D、甲烷分子的四个键完全相同 |
用NA表示阿伏伽德罗常熟的值.下列说法正确的是( )
| A、标准状况下,22.4LH2O中含有的分子数为NA |
| B、常温常压下,32gO2中含有的分子数为NA |
| C、1molMg与足量N2反应时转移的电子数为NA |
| D、1L1mol?L-1CaCl2溶液中含有的氯离子数为NA |
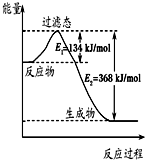 如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是
如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是