题目内容
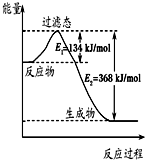 如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是
如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是考点:反应热和焓变,热化学方程式
专题:
分析:加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写.
解答:
解:加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1,
故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1.
故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1.
点评:本题考查较为综合,题目难度中等,本题注意热化学方程式的书写方法和计算应用,注意焓变计算和物质聚集状态的标注,学习中要准确把握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
串联电路中四个电解池分别装有0.5mol?L-1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是( )
| A、KNO3溶液 |
| B、NaCl溶液 |
| C、AgNO3溶液 |
| D、CuCl2溶液 |
下列过程或现象与水解无关的是( )
| A、纯碱溶液去油污 |
| B、配制氯化铁溶液时加入少量的盐酸 |
| C、NaHCO3与Al2(SO4)3混合作泡沫灭火剂 |
| D、铁在潮湿的环境下生锈 |
在纯水中加入下列固体物质,对水的电离平衡不会产生影响的是( )
| A、NaI |
| B、NH4Cl |
| C、K2CO3 |
| D、NaHSO4 |
已知下列两个热化学方程式2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
| A、1:3 | B、2:3 |
| C、3:2 | D、3:1 |
下列关于浓HNO3和浓H2SO4的叙述中正确的是( )
| A、常温下都可用铝制容器贮存 |
| B、露置在空气中,容器内酸液的质量都减轻 |
| C、常温下都能与铜较快反应 |
| D、露置在空气中,容器内酸液的浓度都增大 |
 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0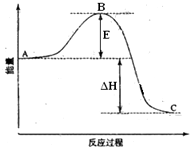 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题: