题目内容
用价层电子对互斥模型预测下列粒子的立体结构是三角锥形的是( )
| A、PCl3 |
| B、BeCl2 |
| C、NH4+ |
| D、SO2 |
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:根据价层电子对互斥理论,粒子的立体结构是三角锥形,说明该离子的中心原子是SP3杂化,且有一对孤电子对,以此来解答.
解答:
解:A、PCl3中心原子P电子对数=3+
=4,中心原子是SP3杂化,且有一对孤电子对,粒子的立体结构是三角锥形,故A正确;
B、BeCl2中心原子Be电子对数=2+
=3,中心原子是SP2杂化,有一对孤电子对,粒子的立体结构是V型,故B错误;
C、NH4+中心原子N电子对数=4+
=4,中心原子是SP3杂化,没有一对孤电子对,粒子的立体结构是正四面体型,故C错误;
D、SO2中心原子S电子对数=2+
=3,中心原子是SP2杂化,有一对孤电子对,粒子的立体结构是V型,故D错误;
故选:A.
| 5-1×3 |
| 2 |
B、BeCl2中心原子Be电子对数=2+
| 4-1×2 |
| 2 |
C、NH4+中心原子N电子对数=4+
| 5-1-1×4 |
| 2 |
D、SO2中心原子S电子对数=2+
| 6-2×2 |
| 2 |
故选:A.
点评:本题考查了分子空间构型的判断,题目难度不大,注意把握离子和分子价层电子对数的判断方法.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
在纯水中加入下列固体物质,对水的电离平衡不会产生影响的是( )
| A、NaI |
| B、NH4Cl |
| C、K2CO3 |
| D、NaHSO4 |
下列离子方程式书写正确的是( )
| A、氢氧化钡与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、氯化铝溶液与过量氨水反应:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
已知下列两个热化学方程式2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
| A、1:3 | B、2:3 |
| C、3:2 | D、3:1 |
已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
| A、反应中硫酸作氧化剂 |
| B、NH4CuSO3中硫元素被氧化 |
| C、1mol NH4CuSO3完全反应转移0.5mol电子 |
| D、刺激性气味的气体是氨气 |
如图是工业制纯碱的部分物质转化示意图,下列推测错误的是( )
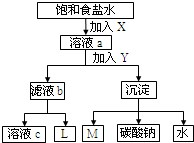

| A、若是氨碱法,溶液c可在转化流程中循环利用 |
| B、若是联碱法,则L的主要成分是NH3 |
| C、M可在转化流程中循环利用 |
| D、X是NH3,Y是CO2 |

 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1.请回答下列问题: