题目内容
温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1mol O2发生反应;2SO2(g)+O2(g)?2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率.下列判断正确的是( )
| A、甲保持压强不变,乙保持体积不变 |
| B、甲保持体积不变,乙保持压强不变 |
| C、混合气体密度甲小于乙 |
| D、混合气体的平均相对分子质量甲小于乙 |
考点:化学平衡的影响因素
专题:
分析:先假定甲、乙的体积都不变,达到平衡后再保持甲的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持甲的压强不变,就需要缩小体积.缩小体积则甲的压强增大,平衡正向移动,SO2的转化率大,再结合ρ=
,平均相对分子质量=
进行计算.
| m |
| V |
| m 总 |
| n 总 |
解答:
解:假定甲、乙的体积都不变,达到平衡后再保持甲的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持甲的压强不变,就需要缩小体积.缩小体积则甲的压强增大,平衡正向移动,SO2的转化率大,故A正确,B错误;
C、根据ρ=
,由以上分析甲的体积小,所以甲的密度大,故C错误;
D、根据平均相对分子质量=
,由以上分析甲的SO2的转化率大,则n总小,所以甲的平均相对分子质量大,故D错误.
故选A.
C、根据ρ=
| m |
| V |
D、根据平均相对分子质量=
| m 总 |
| n 总 |
故选A.
点评:这一类问题的解决方法一般如此,先设为同等条件,平衡后再改变某一条件使之符合题设条件,分析变化.这样,问题就迎刃可解了.

练习册系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
下列图示与对应叙述相符合的是( )
A、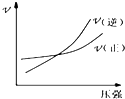 如图:反应N2+3H2?2NH3在恒温情况下,反应速率与压强的关系 |
B、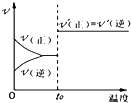 如图:反应H2+I2?2HI 达平衡后,升高温度时反应速率随时间的变化 |
C、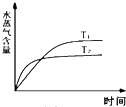 如图:反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
D、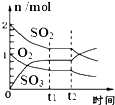 如图:反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
某烃A与Br2发生加成反应生成二溴代物B.B用热的NaOH醇溶液处理得有机物C,经测定C的分子中含有两个双键,其分子式为C5H6.将C在催化条件下加氢可得到分子式为C5H10的有机物D,D的一氯代物只有1种结构.则烃A的结构简式为( )
| A、CH3CH2CH2CH═CH2 |
| B、CH2═CH-CH2-CH═CH2 |
C、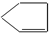 |
D、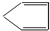 |
下列可逆反应达到平衡后,增大压强同时降低温度,平衡一定向右移动的是( )
| A、2AB(g)?A2(g)+B2(g)△H>0 |
| B、A2(g)+3B2(g)?2AB3(g)△H<0 |
| C、A(s)+B(g)?C(g)+D(g)△H>0 |
| D、2A(g)+B(g)?3C(g)+D(s)△H<0 |
某物质灼烧时,焰色反应为黄色,下列判断中错误的是( )
| A、该物质可能是金属钠 |
| B、该物质一定含钠元素 |
| C、该物质中可能含钾元素 |
| D、该物质一定是钠的化合物 |




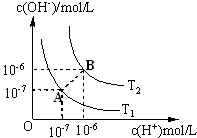 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.