题目内容
某物质灼烧时,焰色反应为黄色,下列判断中错误的是( )
| A、该物质可能是金属钠 |
| B、该物质一定含钠元素 |
| C、该物质中可能含钾元素 |
| D、该物质一定是钠的化合物 |
考点:焰色反应
专题:几种重要的金属及其化合物
分析:焰色反应是元素的性质,灼烧时焰色反应为黄色,说明各物质中含有Na元素,而钠元素的焰色反应的黄光可以掩盖住钾元素的紫光,故要判断是否含有钾元素,必须透过蓝色钴玻璃来观察,依此分析解答.
解答:
解:A、物质灼烧时,焰色反应为黄色,说明该物质中一定含有Na元素,可能为是钠单质或钠的化合物,故A正确;
B、物质灼烧时,焰色反应为黄色,说明该物质中一定含有Na元素,可能为是钠单质或钠的化合物,故B正确;
C、由于钠元素的焰色反应的黄光可以掩盖住钾元素的紫光,故要判断是否含有钾元素,必须透过蓝色钴玻璃来观察,否则不能确定是否含钾元素,故C正确;
D、物质灼烧时,焰色反应为黄色,说明该物质中一定含有Na元素,可能是钠的化合物,但可能是钠单质,故D错误.
故选D.
B、物质灼烧时,焰色反应为黄色,说明该物质中一定含有Na元素,可能为是钠单质或钠的化合物,故B正确;
C、由于钠元素的焰色反应的黄光可以掩盖住钾元素的紫光,故要判断是否含有钾元素,必须透过蓝色钴玻璃来观察,否则不能确定是否含钾元素,故C正确;
D、物质灼烧时,焰色反应为黄色,说明该物质中一定含有Na元素,可能是钠的化合物,但可能是钠单质,故D错误.
故选D.
点评:本题考查焰色反应的相关知识,难度不大.明确焰色反应是元素的性质是解答的关键.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1mol O2发生反应;2SO2(g)+O2(g)?2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率.下列判断正确的是( )
| A、甲保持压强不变,乙保持体积不变 |
| B、甲保持体积不变,乙保持压强不变 |
| C、混合气体密度甲小于乙 |
| D、混合气体的平均相对分子质量甲小于乙 |
四种短周期元素在元素周期表中的相对位置如图所示,w的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W | X | |
| Y | Z |
| A、X元素形成的单核阴离子还原性强于Y的 |
| B、Z元素氧化物对应水化物的酸性一定强于Y |
| C、X、Y、Z中最简单氮化物稳定性最差的是Y |
| D、z元素单质在化学反应中只表现氧化性 |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
A、密闭容器中CuO和C高温反应的气体产物: |
B、Fe在Cl2中的燃烧产物: |
C、NaOH溶液中通入一定量的CO2的产物: |
D、AlCl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: |
下列说法正确的是( )
| A、次氯酸的分子式HClO |
| B、过氧化钠(Na2O2)中氧元素的化合价为-2 |
| C、水晶的化学式为Si |
D、钠离子的结构示意图 |
若NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA |
| B、标准状况下,11.2LNH3所含共价键的数为3NA |
| C、标况下11.2LNO和11.2LO2混合后所得气体分子数为NA |
| D、2Llmol/L的醋酸溶液中所含氢离子数为2NA |
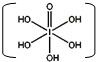 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6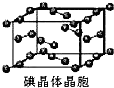 A、用均摊法可知平均每个晶胞中有4个碘原子
A、用均摊法可知平均每个晶胞中有4个碘原子