题目内容
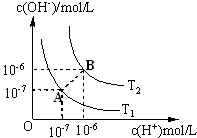 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.(1)若从A点变动到B点,可以采取的措施是
A.加酸溶液 B.加碱溶液 C.加热
(2)现有T1温度下,pH=12的Ba(OH)2溶液.
①该Ba(OH)2溶液的物质的量浓度为
②向该温度下100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量(假设混合溶液的体积等于混合前两溶液的体积和),
此时溶液的pH
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)水的电离是吸热反应,升高温度促进水电离,A点水的离子积常数10-7.10-7=10-14、B点水的离子积常数10-6.10-6=10-12,水的离子积常数只与温度有关;
(2)T1温度下,pH=12的Ba(OH)2溶液,
①该温度下,溶液中c(OH-)=
mol/L=0.01mol/L,c(Ba(OH)2)=
c(OH-);
②根据溶液中的反应判断反应后溶液的酸碱性;根据硫酸根离子和氢氧化钡的关系式计算n(SO42-)总,根据混合溶液的pH计算原来溶液中n(H+)和n(H2SO4),从而得出其中硫酸钠的量.
(2)T1温度下,pH=12的Ba(OH)2溶液,
①该温度下,溶液中c(OH-)=
| 10-14 |
| 10-12 |
| 1 |
| 2 |
②根据溶液中的反应判断反应后溶液的酸碱性;根据硫酸根离子和氢氧化钡的关系式计算n(SO42-)总,根据混合溶液的pH计算原来溶液中n(H+)和n(H2SO4),从而得出其中硫酸钠的量.
解答:
解:(1)水的电离是吸热反应,升高温度促进水电离,A点水的离子积常数10-7.10-7=10-14、B点水的离子积常数10-6.10-6=10-12,水的离子积常数只与温度有关,与溶液酸碱性无关,所以只能是加热才能实现,故选C;
(2)T1温度下,pH=12的Ba(OH)2溶液,
①该温度下,溶液中c(OH-)=
mol/L=0.01mol/L,c(Ba(OH)2)=
c(OH-)=
×0.01mol/L=0.005mol/L,
故答案为:0.005mol/L;
②向100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,硫酸与氢氧化钡反应生成硫酸钡和水,硫酸钠与氢氧化钡反应生成硫酸钡和氢氧化钠,所以反应后有强碱生成,故溶液显碱性,即PH大于7;
据题意知原溶液中n(SO42-)总=n[Ba(OH)2]=0.3L×5×10-3mol?L-1=1.5×10-3 mol;
已知原来硫酸的PH=2,则n(H+)=0.001mol,所以n(H2SO4)=
n(H+)=5×10-4mol,
原混合液中n(Na2SO4)=n(SO42-)总-n(H2SO4)=1.5×10-3 mol-5×10-4mol=1×10-3 mol,
所以c(Na2SO4)=
=mol?L-1=0.01mol?L-1,
故答案为:大于;0.01mol?L-1.
(2)T1温度下,pH=12的Ba(OH)2溶液,
①该温度下,溶液中c(OH-)=
| 10-14 |
| 10-12 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.005mol/L;
②向100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,硫酸与氢氧化钡反应生成硫酸钡和水,硫酸钠与氢氧化钡反应生成硫酸钡和氢氧化钠,所以反应后有强碱生成,故溶液显碱性,即PH大于7;
据题意知原溶液中n(SO42-)总=n[Ba(OH)2]=0.3L×5×10-3mol?L-1=1.5×10-3 mol;
已知原来硫酸的PH=2,则n(H+)=0.001mol,所以n(H2SO4)=
| 1 |
| 2 |
原混合液中n(Na2SO4)=n(SO42-)总-n(H2SO4)=1.5×10-3 mol-5×10-4mol=1×10-3 mol,
所以c(Na2SO4)=
| 10-3 |
| 0.1 |
故答案为:大于;0.01mol?L-1.
点评:本题考查pH的简单计算、离子积常数,明确离子积常数只与温度有关、与溶解酸碱性及浓度无关是解本题关键,题目难度中等.

练习册系列答案
相关题目
温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1mol O2发生反应;2SO2(g)+O2(g)?2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率.下列判断正确的是( )
| A、甲保持压强不变,乙保持体积不变 |
| B、甲保持体积不变,乙保持压强不变 |
| C、混合气体密度甲小于乙 |
| D、混合气体的平均相对分子质量甲小于乙 |
下列说法正确的是( )
| A、次氯酸的分子式HClO |
| B、过氧化钠(Na2O2)中氧元素的化合价为-2 |
| C、水晶的化学式为Si |
D、钠离子的结构示意图 |
若NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA |
| B、标准状况下,11.2LNH3所含共价键的数为3NA |
| C、标况下11.2LNO和11.2LO2混合后所得气体分子数为NA |
| D、2Llmol/L的醋酸溶液中所含氢离子数为2NA |
 某燃煤发电厂的废气中有SO2,它是形成酸雨的罪魁之一.处理SO2一般用生石灰或类似物质来吸收.如图是处理该废气的装置示意图.下列说法不正确的是( )
某燃煤发电厂的废气中有SO2,它是形成酸雨的罪魁之一.处理SO2一般用生石灰或类似物质来吸收.如图是处理该废气的装置示意图.下列说法不正确的是( )| A、此过程中既有分解反应,也有化合反应 |
| B、CaSO4既是氧化产物,又是还原产物 |
| C、使用此废气处理装置可减少酸雨的形成 |
| D、理论上整个过程每转移电子1mol,会对应生成1molCO2 |
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、0.01 mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D、在化学平衡、电离平衡、水解平衡中,平衡常数都随温度的升高而增大 |
已知热化学方程式2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ/mol,则关于热化学方程式2H2O(l)═2H2(g)+O2(g)△H2=?的说法正确的是( )
| A、热化学方程式中化学计量数表示分子数 |
| B、该反应△H2大于零 |
| C、该反应△H2=-571.6 kJ/mol |
| D、该反应与上述反应属于可逆反应 |
