题目内容
4.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
分析 (1)根据平衡常数等于生成物浓度幂之积除以反应物浓度幂之积计算;
(2)温度升高平衡常数增大,说明平衡向正反应方向移动;
(3)计算平衡常数的值,可找出对应温度;
(4)根据Qc=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,判断与K的相对大小,确定反应进行的方向.
解答 解:(1)平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,故答案为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(2)温度升高平衡常数增大,说明平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
(3)由c(CO2)•c(H2)=c(CO)•c(H2O),可知k=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$=1.0,温度为730℃,故答案为:830;
(4)若1200℃时K=2.6,某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,Qc=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$=4>K,说明平衡逆向移动,即此时上述反应的平衡移动方向为逆反应方向,
答案为:逆反应方向.
点评 本题考查化学平衡的计算,主要是平衡常数与Qc的关系的应用,题目难度不大,注意平衡常数的利用和计算.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
14.以下操作或实验装置可以用于分离物质的是( )
| A. |  | B. |  | C. |  | D. |  |
12.下列实验能达到预期目的是( )
| A. | 检验溶液中是否含有 CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 | |
| B. | 检验溶液中是否含有 NH4+:先滴加浓 NaOH 溶液并加热,再用湿润的红色石 蕊试纸 | |
| C. | 检验溶液中是否含有 Fe2+:先滴加氯水,再滴加 KSCN 溶液 | |
| D. | 检验溶液中是否含有 SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
19.下列有关有机物的结构说法不正确的是( )
| A. | 溴苯中的所有原子处于同一平面中 | |
| B. | 氯乙烯中所有原子不可能处于同一平面中 | |
| C. | 3-甲基戊烷的一氯代产物有4种(不考虑立体异构) | |
| D. | 分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构) |
9.20世纪90年代初,国际上提出了“预防污染”这一新概念.绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度的节约能源,在化工生产各环节都实现净化和无污染的反应途径.下列各项属于“绿色化学”的是( )
| A. | 处理废弃物 | B. | 治理污染物 | C. | 减少有毒物 | D. | 杜绝污染源 |
16.如图所示装置,其中R为直流电源,以下说法中不正确的是( )
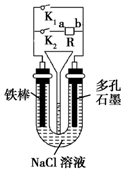

| A. | 若只闭合K1,则铁棒发生的是吸氧腐蚀 | |
| B. | 若要保护铁棒不被腐蚀,则只闭合K2且a极为负极 | |
| C. | 若只闭合K2,一段时间后,U形管中出现白色沉淀,则a极为正极 | |
| D. | 先只闭合K2,两极均产生气体,漏斗液面上升,然后再只闭合K1,漏斗液面不会下降 |
13.下列说法正确的是( )
| A. | 用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| B. | 乙烯和苯均能使酸性高锰酸钾溶液褪色 | |
| C. | 苯在空气中燃烧时冒浓烟,说明苯组成中含碳量较高 | |
| D. | 间二甲苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 |
1.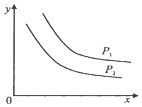 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a+1<b |