题目内容
14.以下操作或实验装置可以用于分离物质的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A.图为固体与液体反应制备气体的装置;
B.图为过滤装置;
C.图为液体的取用;
D.图为浓硫酸的稀释.
解答 解:A.为固液反应制备气体,不能分离提纯混合物,故A不选;
B.不溶性固体与液体可利用图中装置分离,故B选;
C.图中取用液体,为基本操作,不能分离混合物,故C不选;
D.为浓硫酸的稀释操作,不能分离混合物,故D不选;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、实验基本操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.某无色溶液中,由水电离出的c(H+)=1×10-14mo1•L-1,则该溶液中,一定能大量共存的离子组是( )
| A. | K+、Na+、MnO4-、SO42- | B. | K+、Cl-、Ba2+、HCO3- | ||
| C. | K+、Na+、Cl-、Br- | D. | Na+、CO32-、A1O2-、C1- |
5.A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.则下列说法正确的是( )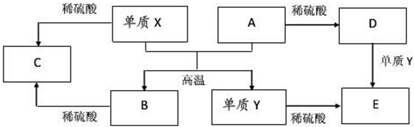

| A. | 单质X与A反应的化学方程式:Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| B. | 检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 单质X和单质Y在一定条件下均能与水发生置换反应 | |
| D. | 由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性氧化物 |
2.下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是( )
| A. | 2AB(g)?A2(g)+B2(g)△H>0 | B. | A2(g)+3B2(g)?2AB3(g)△H<0 | ||
| C. | A(s)+B(g)?C(g)+D(g)△H>0 | D. | 2A(g)+B(g)?3C(g)+D(s)△H<0 |
6.在密闭容器中发生下列反应:aA(g)═cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a<c+d(填“>”、“=”或“<”).
3.下列实验仪器不能用来加热的是( )
| A. | 试管 | B. | 坩埚 | C. | 分液漏斗 | D. | 烧杯 |
4.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)