题目内容
12.下列实验能达到预期目的是( )| A. | 检验溶液中是否含有 CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 | |
| B. | 检验溶液中是否含有 NH4+:先滴加浓 NaOH 溶液并加热,再用湿润的红色石 蕊试纸 | |
| C. | 检验溶液中是否含有 Fe2+:先滴加氯水,再滴加 KSCN 溶液 | |
| D. | 检验溶液中是否含有 SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
分析 A.能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,原溶液中可能含有亚硫酸根离子、亚硫酸氢根离子;
B.检验铵根离子先用浓碱液加热,然后用湿润的红色石 蕊试纸;
C.检验亚铁离子时,应该先加入硫氰化钾溶液,溶液不变红,然后再加入氯水;
D.加入氯化钡溶液,生成的沉淀可能为氯化银,应该先加入稀盐酸,排除干扰离子.
解答 解:A.滴加稀盐酸,将产生的气体通入澄清石灰水,若石灰水变浑浊,原溶液中不一定含有CO32-,可能含有SO32-、HCO3-等离子,故A错误;
B.检验溶液中是否含有 NH4+的方法为:先滴加浓 NaOH 溶液并加热,再用湿润的红色石蕊试纸,若试纸变蓝,说明原溶液中含有铵根离子,故B正确;
C.检验溶液中是否含有 Fe2+,应该先滴KSCN溶液,溶液不变红,再滴加氯水,顺序不能颠倒,故C错误;
D.检验溶液中是否含有 SO42-,应该先滴加稀盐酸,没有沉淀生成,然后再滴加氯化钡溶液,加入顺序不能颠倒,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
2.下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是( )
| A. | 2AB(g)?A2(g)+B2(g)△H>0 | B. | A2(g)+3B2(g)?2AB3(g)△H<0 | ||
| C. | A(s)+B(g)?C(g)+D(g)△H>0 | D. | 2A(g)+B(g)?3C(g)+D(s)△H<0 |
3.下列实验仪器不能用来加热的是( )
| A. | 试管 | B. | 坩埚 | C. | 分液漏斗 | D. | 烧杯 |
17.根据所给的信息和标志,判断下列说法错误的是( )
| A | B | C | D |
 | 碳酸氢钠药片 |  |  |
| 如图为铝热反应的实验装置,工业上利用铝热反应大量冶炼金属铁 | 如图现象为丁达尔效应,丁达尔效应可用于鉴别溶液和胶体 | 如图药品属抗酸药,可治疗胃酸过多 | 看到有该标志的丢弃物,应远离并报警 |
| A. | A | B. | B | C. | C | D. | D |
4.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
1.向盛有饱和氯化钡溶液中通入SO2气体,再通入下列气体,能产生沉淀且沉淀组成相同的是( )
①NH3 ②NO2 ③H2S ④SO3 ⑤O2 ⑥Cl2 ⑦NO ⑧HCl.
①NH3 ②NO2 ③H2S ④SO3 ⑤O2 ⑥Cl2 ⑦NO ⑧HCl.
| A. | ①②⑥ | B. | ③④⑦ | C. | ②⑤⑦ | D. | ②④⑤⑥ |
9.如表为第二、三周期某些元素性质的数据,下列说法正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径/10-10 nm | 0.73 | 1.30 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| 最高或最低化合价 | -2 | +2 | +1 | +5 | +7 | +1 | -3 | +6 |
| A. | ③和⑤处于同一周期 | |
| B. | 气态氢化物的稳定性④大于⑧ | |
| C. | 上述八种元素最高价氧化物对应的水化物中,⑤的酸性最强 | |
| D. | ①与⑥只能形成一种化合物 |
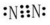 .
.