题目内容
16.如图所示装置,其中R为直流电源,以下说法中不正确的是( )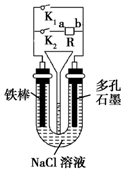
| A. | 若只闭合K1,则铁棒发生的是吸氧腐蚀 | |
| B. | 若要保护铁棒不被腐蚀,则只闭合K2且a极为负极 | |
| C. | 若只闭合K2,一段时间后,U形管中出现白色沉淀,则a极为正极 | |
| D. | 先只闭合K2,两极均产生气体,漏斗液面上升,然后再只闭合K1,漏斗液面不会下降 |
分析 A、水膜呈中性,铁是负极,氧气是正极;
B、铁连接电源负极,为阴极,被保护不易腐蚀;
C、a极为正极,铁是阳极,铁发生氧化反应,多孔石墨是阴极,氧气得到电子;
D、先只闭合K2,两极均产生气体,则a为负极,漏斗液面上升,然后再只闭合K1,构成原电池,生成氯化氢.
解答 解:A、水膜呈中性,铁是负极,氧气是正极发生吸氧腐蚀,故A正确;
B、铁连接电源负极,为阴极,被保护不易腐蚀,所以只闭合K2且a极为负极,故B正确;
C、a极为正极,铁是阳极,铁发生氧化反应,生成亚铁离子,多孔石墨是阴极,氧气得到电子,生成氢氧根离子,所以亚铁离子与氢氧根离子反应生成氢氧化亚铁,所以U形管中出现白色沉淀,故C正确;
D、先只闭合K2,两极均产生气体,则a为负极,漏斗液面上升,然后再只闭合K1,构成原电池,生成氯化氢,极易溶于水,所以漏斗液面下降,故D错误;
故选D.
点评 本题考查原电池知识,侧重于金属的腐蚀与防护的考查,注意把握原电池的工作原理以及金属的防护方法,难度不大.

练习册系列答案
相关题目
6.在密闭容器中发生下列反应:aA(g)═cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a<c+d(填“>”、“=”或“<”).
4.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
11.四种仪器中,不能用来加热的是( )
| A. |  烧杯 | B. |  容量瓶 | C. |  试管 | D. |  烧瓶 |
1.向盛有饱和氯化钡溶液中通入SO2气体,再通入下列气体,能产生沉淀且沉淀组成相同的是( )
①NH3 ②NO2 ③H2S ④SO3 ⑤O2 ⑥Cl2 ⑦NO ⑧HCl.
①NH3 ②NO2 ③H2S ④SO3 ⑤O2 ⑥Cl2 ⑦NO ⑧HCl.
| A. | ①②⑥ | B. | ③④⑦ | C. | ②⑤⑦ | D. | ②④⑤⑥ |
8.化学在生活中应用广泛,下列物质性质与对应用途错误的是( )
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | 溴化银见光易分解,可用作胶片感光剂 |
12.化学与生产和生活密切相关.下列过程中没有发生化学变化的是( )
| A. | 氯气作水杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 铝热剂应用于焊接钢轨 |
13.如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法错误的是( )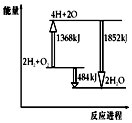

| A. | 拆开2molH2(g)和1molO2(g)中的化学键共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 1molH2(g)和$\frac{1}{2}$molO2(g)反应生成1molH2O(l),放出热量小于242kJ | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ热量 |
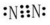 .
.