题目内容
15.按要求回答:(1)用pH试纸测定0.1mol•L-1的纯碱溶液的pH,其正确的操作是把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH.
(2)实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以抑制(填“促进”、“抑制”)其水解.把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3.
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是AB
A.未用标准液润洗碱式滴定管;
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
(4)在25℃下,向浓度均为0.20mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2 沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=9.0×108(已知25℃时Ksp=1.8×10-11,KsP=2.0×10-20)
分析 (1)根据PH试纸的使用方法分析;
(2)为抑制氯化铁的水解,在配制氯化铁溶液时应该将氯化铁固体溶于较浓的盐酸中;盐类水解为吸热过程,加热促进水解,氯化氢具有挥发性,蒸干、灼烧最后得到的是氧化铁;
(3)根据c=$\frac{n}{v}$,看是哪一个物理量影响产生的误差;
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Cu(OH)2先生成沉淀,离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,当溶液中C(Cu2+)=10-5 mol/L时,认为铜离子完全沉淀,再根据氢氧化镁溶度积常数、pH计算c(Mg2+).
解答 解:(1)PH试纸的正确使用方法是:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH,故答案为:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH;
(2)为抑制氯化铁的水解,在配制氯化铁溶液时应该将氯化铁固体溶于较浓的盐酸中;在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热发生反应:2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,故答案为:抑制;Fe2O3;
(3)A、未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,可知c(酸)偏高,故A正确.
B、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,这一滴标准液没有参加反应,又计算在了标准液中,会导致测定结果偏高,故B正确;
C、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,操作正确,不会影响测定结果,故C错误
D、滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致标准液的体积读数偏小,测定结果偏低,故D错误;
故答案为:AB;
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Cu(OH)2先生成沉淀,离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,溶液pH=11,则溶液中c(OH-)=0.001mol/L,再根据溶度积常数得c(Mg2+)=$\frac{1.8×1{0}^{-11}}{0.00{1}^{2}}$mol/L=1.8×10-5mol/L,c(Cu2+)=$\frac{2.0×1{0}^{-20}}{(1{0}^{-3})^{2}}$mol/L=2.0×10-14mol/L,所以c(Mg2+):c(Cu2+)=1.8×10-5mol/L:2.0×10-14mol/L=9.0×108,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;9.0×108.
点评 本题考查的内容综合性很强,考查了溶液的配制、滴定操作等内容,难度较大,注意认真审题.

 名校课堂系列答案
名校课堂系列答案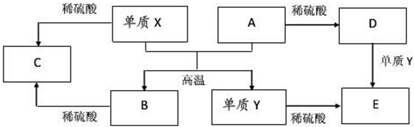
| A. | 单质X与A反应的化学方程式:Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| B. | 检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 单质X和单质Y在一定条件下均能与水发生置换反应 | |
| D. | 由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性氧化物 |
| A. | 试管 | B. | 坩埚 | C. | 分液漏斗 | D. | 烧杯 |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、
2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向.(选填“正反应方向”、“逆反应方向”、“不移动”)
| A. | 氯气作水杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 铝热剂应用于焊接钢轨 |
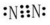 .
.