题目内容
16.在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是( )| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S↓+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | AgNO3+NaCl═AgCl↓+NaNO3 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,化学反应中有化学键的断裂和形成,据此分析解答.
解答 解:A.2Na+2H2O=2NaOH+H2↑中有共价键的断裂、离子键的形成、共价键的形成,没有离子键的断裂,故A错误;
B.SO2+2H2S=3S+2H2O中有共价键的断裂和形成,没有离子键的断裂和形成,故B错误;
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑中有离子键的断裂和形成、共价键的断裂和形成,故C正确;
D.AgNO3+NaCl═AgCl↓+NaNO3中有离子键的断裂和形成,没有共价键的断裂和形成,故D错误;
故选C.
点评 本题考查了化学键和化学反应,明确化学键的断裂位置是解本题关键,注意特殊物质化学键的断裂方式,题目难度中等.

练习册系列答案
相关题目
7.有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
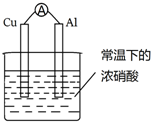

| A. | Cu是原电池的负极 | |
| B. | 电流由Cu电极流出 | |
| C. | 电子由Al沿导线流向Cu | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
4.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 离子半径:X+>Z- | C. | 稳定性:H2Y>HZ | D. | 碱性:XOH>W(OH)3 |
11.用氯化铝制取纯净的硝酸铝的最佳方法是( )
| A. | 用氯化铝和纯硝酸反应 | |
| B. | 氯化铝与氢氧化钠反应,过滤得沉淀,再加稀HNO3 | |
| C. | 用AlCl3溶液和氨水反应,过滤得沉淀,再加稀HNO3 | |
| D. | AlCl3溶液和Ba(NO3)2溶液反应 |
1.下列关于晶体的说法中,不正确的是( )
①晶胞是晶体结构的基本单元
②分子晶体若是密堆积方式,其配位数都是12
③含有离子的晶体一定是离子晶体
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6.
①晶胞是晶体结构的基本单元
②分子晶体若是密堆积方式,其配位数都是12
③含有离子的晶体一定是离子晶体
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6.
| A. | ①③④⑦ | B. | ②④⑥⑧ | C. | ③⑤⑦⑧ | D. | ③④⑥⑦ |
8.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | 至少存在5种离子 | |
| B. | CO32-、Al3+一定不存在,K+可能存在 | |
| C. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| D. | Cl-一定存在 |
5.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法中正确的是( )
| X | Y | |||
| W |
| A. | 五种元素中,原子半径最大的是W | |
| B. | Y 的氧化性比W的氧化性强 | |
| C. | Y与Z形成的化合物都可以和水反应 | |
| D. | Z与Q形成的化合物一定是离子化合物 |
6.在以下的分子或离子中,VSEPR模型名称与该粒子的立体构型名称一致的是( )
| A. | NF3 | B. | C${H}_{3}^{-}$ | C. | SO3 | D. | H3O+ |