题目内容
19.常温下,向10mL 0.1mol/L的H2C2O4溶液中逐滴加入0.1mol/LKOH溶液,所得滴定曲线如图所示.下列说法正确的是( )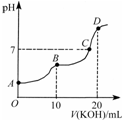
| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(HC2O4-)>c(K+)>c(H+)>c(OH-) | |
| C. | C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
分析 草酸和KOH反应方程式依次为H2C2O4+KOH=KHC2O4+H2O、KHC2O4+KOH=K2C2O4+H2O,
A.B点二者恰好反应生成KHC2O4,根据图知,该点pH<7;
B.B点二者恰好反应生成KHC2O4,溶液呈酸性,说明HC2O4-电离程度大于水解程度,但其电离和水解程度都较小,钾离子不水解;
C.C点混合溶液呈中性,溶液呈中性,c(H+)=c(OH-),结合电荷守恒得c(K+)=c(HC2O4-)+2c(C2O4 2- ),结合溶液中的溶质判断离子浓度关系;
D.D点二者恰好反应生成K2C2O4,C2O42-水解导致溶液呈碱性,根据质子守恒判断.
解答 解:草酸和KOH反应方程式依次为H2C2O4+KOH=KHC2O4+H2O、KHC2O4+KOH=K2C2O4+H2O,
A.B点二者恰好反应生成KHC2O4,根据图知,该点pH<7,溶液呈酸性,故A错误;
B.B点二者恰好反应生成KHC2O4,溶液呈酸性,说明HC2O4-电离程度大于水解程度,但其电离和水解程度都较小,钾离子不水解,所以离子浓度大小顺序是c(K+)>c(HC2O4-)>c(H+)>c(OH-),故B错误;
C.C点时,溶液呈中性,c(H+)=c(OH-),结合电荷守恒得c(K+)=c(HC2O4-)+2 c(C2O4 2- ),此点溶液中的溶质是草酸钠,草酸氢根离子水解较微弱,所以c(C2O4 2- )>c(H2C2O4),则c(HC2O4-)+c(C2O4 2- )+c(H2C2O4)<c(K+)<c(HC2O4-)+2 c(C2O4 2- )+c(H2C2O4),故C正确;
D.D点二者恰好反应生成K2C2O4,C2O42-水解导致溶液呈碱性,根据质子守恒得c(H+)+c(C2O4 2- )+2c(H2C2O4)=c(OH-),故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确各点溶液中溶质及其性质是解本题关键,会根据溶液酸碱性确定水解和电离程度相对大小,题目难度不大.

| A. | 44.5kJ/mol | B. | 1364.7kJ/mol | C. | 2729.3kJ/mol | D. | 89.0kJ/mol |
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂,其中硫元素被还原 | |
| C. | FeS既不是氧化产物也不是还原产物 | |
| D. | 在转移了3mol电子的同时,有0.5 mol的SO2生成 |
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物所具有的总键能大于反应物所具有的总键能时,反应为吸热反应 | |
| C. | 生成物的总能量大于反应物的总能量时,△H>0 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
| 物质 | X | Y | Z | W |
| 初始浓度/mol•L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
| A. | 增大压强反应的平衡常数不变,但X的转化率增大 | |
| B. | 该反应的化学方程式为:4X (g)+5Y (g)?4Z (g)+6W (g) | |
| C. | 反应达到平衡时,X的转化率为80% | |
| D. | 其它条件不变,若增大Y的起始浓度,X的转化率增大 |
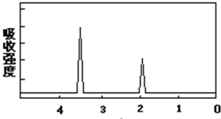 某有机物的分子式是C2H6O2,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,其核磁共振氢普如图所示.该有机物的结构简式是HOH2C-CH2OH.
某有机物的分子式是C2H6O2,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,其核磁共振氢普如图所示.该有机物的结构简式是HOH2C-CH2OH.