题目内容
一定量盐酸与过量铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量( )
①NH4Cl固体;②H2O;③CH3COONa固体;④NaNO3固体.
①NH4Cl固体;②H2O;③CH3COONa固体;④NaNO3固体.
| A、②③ | B、①② | C、②④ | D、①③ |
考点:化学反应速率的影响因素
专题:电离平衡与溶液的pH专题
分析:盐酸与过量铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,则减小氢离子浓度,不能改变氢离子的物质的量即可,以此来解答.
解答:
解:①加NH4Cl固体,铵根离子水解生成氢离子,与Fe反应生成氢气增多,故不选;
②加H2O,减小氢离子浓度,不能改变氢离子的物质的量,故选;
③加CH3COONa固体,与盐酸电离的氢离子结合生成弱电解质,减小氢离子浓度,不能改变氢离子的物质的量,故选;
④加NaNO3固体,在酸性溶液中与Fe发生氧化还原反应生成NO,不生成氢气,故不选;
故选A.
②加H2O,减小氢离子浓度,不能改变氢离子的物质的量,故选;
③加CH3COONa固体,与盐酸电离的氢离子结合生成弱电解质,减小氢离子浓度,不能改变氢离子的物质的量,故选;
④加NaNO3固体,在酸性溶液中与Fe发生氧化还原反应生成NO,不生成氢气,故不选;
故选A.
点评:本题考查化学反应速率的影响因素,为高频考点,把握习题中的信息及浓度对反应速率的影响为解答的关键,注重基础知识的考查,加NaNO3固体为解答的易错点,题目难度不大.

练习册系列答案
相关题目
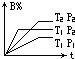 反应aA(g)+bB(g)?cC(g)△H=Q kJ/mol在不同温度(T1、T2)和不同压强(P1、P2)下,B的百分含量(B%)与时间的关系如图,则下列说法正确的是( )
反应aA(g)+bB(g)?cC(g)△H=Q kJ/mol在不同温度(T1、T2)和不同压强(P1、P2)下,B的百分含量(B%)与时间的关系如图,则下列说法正确的是( )| A、a+b<c,Q>0 |
| B、a+b>c,Q>0 |
| C、a+b<c,Q<0 |
| D、a+b>c,Q<0 |
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
| A、HCl NH4Cl CH3COOH NaNO3 Na2CO3 NaHCO3 NaOH |
| B、HCl NH4Cl CH3COOH NaHCO3 NaNO3 Na2CO3 NaOH |
| C、HCl CH3COOH NH4Cl NaNO3 NaHCO3 Na2CO3 NaOH |
| D、HCl CH3COOH NH4Cl NaNO3 Na2CO3 NaHCO3 NaOH |
下列实验方案合理的是( )
| A、鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 |
| B、检验酒精中的少量水:向酒精中加入足量生石灰 |
| C、制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、除去乙炔中杂质气体:将实验室制得的乙炔气体通入硫酸铜溶液 |
下列关于氟氯烃的说法中,不正确的是( )
| A、氟氯烃是一类含氟和氯的卤代烃 |
| B、氟氯烃化学性质稳定,有毒 |
| C、氟氯烃大多数无色,无臭,无毒 |
| D、在平流层,氟氯烃在紫外线照射下,分解产生氯原子可引发损耗O3的循环反应 |
设NA为阿伏加德罗常数,下面叙述正确的是( )
| A、标准状况下,11.2L SO3所含分子数为0.5 NA |
| B、1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C、64g二氧化硫含有原子数为3NA |
| D、在反应中,1mol镁转化为Mg2+后失去的电子数为NA |
 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: