题目内容
6.对金属制品进行抗腐蚀处理,可延长其使用寿命.(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O=2AlO2-+3H2↑(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b.
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为2Al+3H2O-6e-═Al2O3+6H+.取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是(用离子方程式表示)HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀.
(2)芒硝化学式Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
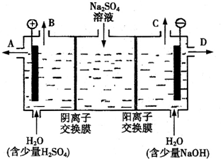
①该电解槽的阳极反应式为4OH--4e-=2H2O+O2↑.此时通过阴离子交换膜的离子数小于(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钠溶液从出口(填写“A”、“B”、“C”或“D”)D导出.
分析 (1)①Al能与碱溶液反应生成氢气;碱洗槽液中的铝以偏铝酸盐形式存在,转化Al(OH)3回收,应利用弱酸,防止Al(OH)3溶解;
②阳极发生氧化反应,Al在阳极放电,由题意可知生成Al2O3,由元素守恒可知应有水参加反应,根据电荷守恒有氢离子生成;
废电解液中含有H+、少量Al3+,HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)阳极发生氧化反应,水在阳极失去电子生成氧气与氢离子,阴极发生还原反应,水在阴极获得电子生成氢气与氢氧根离子,硫酸钠反应中硫酸根离子通过阴离子交换膜移向阳极室,会得到硫酸,钠离子通过阳离子交换膜移向阴极室,会得到NaOH,根据电荷守恒判断通过阴离子交换膜的离子数与通过阳离子交换膜的离子数关系.
解答 解:(1)①碱洗时常有气泡冒出,是因为铝能与强碱反应产生氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,碱洗槽液中的铝以偏铝酸盐形式存在,转化Al(OH)3回收,应利用弱酸,防止Al(OH)3溶解,可以向溶液中通入CO2,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;b;
②阳极发生氧化反应,Al在阳极放电,由题意可知生成Al2O3,由元素守恒可知应有水参加反应,根据电荷守恒有氢离子生成,阳极电极反应式为:2Al+3H2O-6e-═Al2O3+6H+,
加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)阳极发生氧化反应,水在阳极失去电子生成氧气与氢离子,阴极发生还原反应,水在阴极获得电子生成氢气与氢氧根离子,硫酸钠反应中硫酸根离子通过阴离子交换膜移向阳极室,会得到硫酸,钠离子通过阳离子交换膜移向阴极室,会得到NaOH.
①该电解槽的阳极反应式为:4OH--4e-=2H2O+O2↑,硫酸根离子通过阴离子交换膜移向阳极室,钠离子通过阳离子交换膜移向阴极室,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数.
故答案为:4OH--4e-=2H2O+O2↑;小于;
②阴极室是放电生成氢气,同时得到NaOH,气体从上口C放出,则NaOH溶液从D口流出,
故答案为:D.
点评 本题考查化学工艺流程与电解原理应用,关键是明确原理,侧重考查学生信息获取与知识迁移应用能力,难度中等.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯和浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| C. | 甲苯在合适条件下催化加氢可生成甲基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
| A. |  海水蒸馏 | B. |  钾在空气中的燃烧 | ||
| C. |  测定中和热 | D. |  牺牲阳极的阴极保护法 |
| A. | Fe3+、OH-、NO3- | B. | Ca2+、Na+、HCO3- | C. | OH-、Cl-、NH4+ | D. | H+、HCO3-、Cl- |
| A. | 氨水 | B. | 碳酸钠溶液 | C. | 碘水 | D. | 盐酸 |
| A. | 浓硫酸可用于干燥Cl2和NH3 | |
| B. | 正常雨水的pH小于7 | |
| C. | CCl4可用于萃取碘水中的碘,但酒精不可以用于萃取碘水中的碘 | |
| D. | Si可用于制造光导纤维 |
(1)氮、磷、砷的电负性的大小关系是N>P>As,砷原子M层电子排布式为3s23p63d10.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是
Fe3+提供空轨道,CN-提供孤电子形成配位键.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,沸点高低的原因是CH4和SiH4比较,影响熔沸点的因素是分子间作用力,SiH4之间的分子间作用力大,熔沸点高.
②NH3和PH3比较,分解温度高低的原因是NH3和PH3比较,影响分解温度的因素是共价键的强弱,N原子的半径比P原子的半径小,共价键的键长短,供价键强,分解温度高.
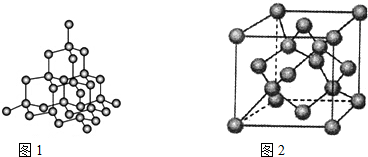
(4)金刚石是原子晶体,含有的最小环是六元环(如图2),每个碳原子连接12个六元环,如图1是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率$\frac{32π{r}^{3}}{3{a}^{3}}$×100%(不要求计算过程).
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| C. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量Na2CO3固体,平衡向逆反应方向移动,c(OH-)>c(H+) |
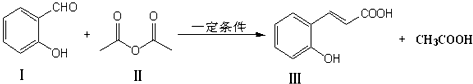
 ,其中反应(1)的条件是氢氧化钠水溶液、加热;
,其中反应(1)的条件是氢氧化钠水溶液、加热;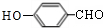 ;
; 也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为
也能与化合物Ⅱ发生类似反应①的反应,除CH3COOH外,另一种有机产物的结构简式为 .
.