题目内容
6.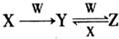 已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.
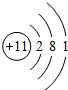
已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.(1)写出C元素的原子结构示意图
 ,用电子式写出C和E形成化合物的过程
,用电子式写出C和E形成化合物的过程 ,用电子式写出A和B形成化合物的过程
,用电子式写出A和B形成化合物的过程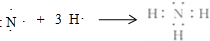 .
.(2)B元素的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在化学键的类型为离子键、共价键.
(3)C元素的最高价氧化物对应的水化物与D元素的最高价氧化物反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示转化关系.
①X、Y、Z均含有上述元素中的同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程为CO32-+CO2+H2O═2HCO3-;
②X、Y、Z均含有上述元素中的同一种金属元素,若W是强碱,且Y为白色难溶固体,则反应Z→Y的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓.
③X、Y、Z是均含有上述元素中的同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
分析 A、B、C、D、E是原子序数依次增大的五种短周期元素,E元素的最高正化合价与最低化合价的代数和为6,则E为Cl;A与B形成共价化合物的水溶液呈碱性,可推知A为H元素、B为N元素;A、C同主族,C的原子序数大于N元素,则C为Na元素,D处于第三周期,且D是同周期中离子半径最小的元素,则D为Al元素.
(4)①X、Y、Z均含有上述元素中的同一种金属元素,若W固体俗称干冰,则X为NaOH,Y为碳酸钠、Z为碳酸氢钠;
②X、Y、Z均含有上述元素中的同一种金属元素,若W是强碱,且Y为白色难溶固体,则W为NaOH,Y为氢氧化铝,X为铝盐、Z为偏铝酸钠;
③X、Y、Z均含有同一种非金属元素,W是一种常见金属单质,且上述转化均在常温条件下完成,则W为Fe元素,X为硝酸、Y为硝酸铁、Z为硝酸亚铁.
解答 解:A、B、C、D、E是原子序数依次增大的五种短周期元素,E元素的最高正化合价与最低化合价的代数和为6,则E为Cl;A与B形成共价化合物的水溶液呈碱性,可推知A为H元素、B为N元素;A、C同主族,C的原子序数大于N元素,则C为Na元素,D处于第三周期,且D是同周期中离子半径最小的元素,则D为Al元素.
(1)C为Na,原子结构示意图为 ,C和E形成化合物为NaCl,用电子式表示形成过程:
,C和E形成化合物为NaCl,用电子式表示形成过程: ,A和B形成化合物为NH3,用电子式表示形成的过程:
,A和B形成化合物为NH3,用电子式表示形成的过程: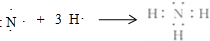 ,
,
故答案为: ;
; ;
;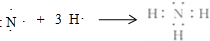 ;
;
(2)B为N元素,B元素的气态氢化物为氨气,其最高价氧化物的水化物为硝酸,二者反应生成的化合物为硝酸铵,硝酸铵中存在离子键和共价键,
故答案为:离子键、共价键;
(3)C为Na元素,最高价氧化物对应的水化物为NaOH,D元素的最高价氧化物为Al2O3,二者反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)①X、Y、Z均含有上述元素中的同一种金属元素,若W固体俗称干冰,则X为NaOH,Y为碳酸钠、Z为碳酸氢钠,则反应Y→Z的离子方程为:CO32-+CO2+H2O═2HCO3-,
故答案为:CO32-+CO2+H2O═2HCO3-;
②X、Y、Z均含有上述元素中的同一种金属元素,若W是强碱,且Y为白色难溶固体,则W为NaOH,Y为氢氧化铝,X为铝盐、Z为偏铝酸钠,则反应Z→Y的离子方程式为:3AlO2-+Al3++6H2O═4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O═4Al(OH)3↓;
③XX、Y、Z均含有同一种非金属元素,W是一种常见金属单质,且上述转化均在常温条件下完成,则W为Fe元素,X为硝酸、Y为硝酸铁、Z为硝酸亚铁,则反应Z→Y的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
点评 本题考查元素化合物推断,熟练掌握元素化合物性质、中学常见连续反应,注意对基础知识的理解掌握.

| A. | NH3、NO2 | B. | NaCl、KF | C. | NaOH、Ca(OH)2 | D. | MgO、H2O2 |
| A. | $\frac{W}{A+16}$(A-N+8)mol | B. | $\frac{W}{A+16}$(A-N+10)mol | C. | (A-N+8)mol | D. | $\frac{W}{A}$(A-N+6)mol |
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 配制一定物质的量浓度的溶液,定容时俯视刻度线,会使所配溶液浓度偏高 | |
| C. | 二氧化硅不与强酸反应,可用石英作为反应容器制取氢氟酸 | |
| D. | 燃着的镁条伸入盛满二氧化碳的集气瓶中,不能继续燃烧 |
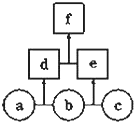 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )| A. | d和e分子中所有原子都不满足8电子结构 | |
| B. | 单质c的氧化性强于单质a | |
| C. | 相同状况下,单质c、a、b的沸点逐渐减小 | |
| D. | f可电离生成两种含10个电子的离子 |
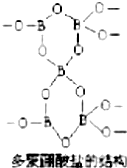 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )| A. | 3,9 | B. | 2,4 | C. | 2,5 | D. | 3,6 |
| A. | 离子半径:D>C>B | |
| B. | B的氢化物比C的氢化物更稳定 | |
| C. | C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA | |
| D. | 由A、B、C形成的化合物一定只有共价键没有离子键 |
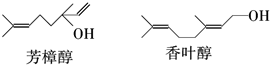
已知
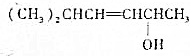 的键线式结构为
的键线式结构为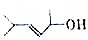 下列说法不正确的是( )
下列说法不正确的是( )| A. | 两种醇都能与溴水反应 | |
| B. | 两种醇互为同分异构体 | |
| C. | 两种醇与氧气在铜催化的条件下,均可被氧化为相应的醛 | |
| D. | 两种醇在浓H2S04存在下加热,均可与乙酸发生酯化反应 |
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.